 10 % pacientov s GERD rozvinie Barrettov pažerák, rizikový faktor pre rakovinu pažeráka.
10 % pacientov s GERD rozvinie Barrettov pažerák, rizikový faktor pre rakovinu pažeráka.

Barrettov pažerák nemá žiadne jedinečné príznaky. Pacienti s Barrettovou chorobou majú príznaky GERD alebo kyslého refluxu zahŕňajú nasledovné:
Barrettov pažerák je komplikáciou chronickej gastroezofageálnej refluxnej choroby (GERD), predovšetkým u bielych mužov. GERD je ochorenie, pri ktorom dochádza k refluxu kyslej tekutiny zo žalúdka do pažeráka (prehĺtacie trubice). GERD najčastejšie spôsobuje pálenie záhy.
Na diagnostiku Barrettovho pažeráka existujú dve požiadavky. Požiadavky si vyžadujú endoskopiu pažeráka. Počas endoskopie sa cez ústa a dole do pažeráka vloží dlhá ohybná trubica so svetlom a kamerou na konci (endoskop), aby sa zobrazila a odobrala biopsia (vzorka tkaniva z) výstelky pažeráka. Dve požiadavky sú:
Barrettov pažerák je oficiálne kódovaný Kongresovou knižnicou pre elektronické vyhľadávanie v literatúre ako Barrettov pažerák, ale Barrettov pažerák (s apostrofom „s“) je názov používaný všeobecne. Tento stav je pomenovaný po chirurgovi Normanovi Barrettovi, ktorý stav opísal. Ukazuje sa však, že jeho interpretácia nálezov nebola správna. V roku 1953 Doctors' Allison a Johnstone skutočne opísali tento stav tak, ako ho teraz chápeme, teda že sa vyskytla metaplázia. (Metaplázia, ktorá je diskutovaná nižšie, je termín používaný, keď jedno dospelé tkanivo nahrádza iné.) Napriek tomu bol tento stav zvečnený s Barrettovým menom.
Pôvodne sa predpokladalo, že Barrettov pažerák pozostáva zo žalúdočného (žalúdočného) tkaniva nahrádzajúceho zvyčajné skvamózne tkanivo lemujúce pažerák. V polovici 70-tych rokov však Dr. Paull a jeho kolegovia publikovali prácu, v ktorej popísali sliznicu (vnútornú výstelku) Barrettovho pažeráka podrobnejšie ako predtým. Poukázali na to, že Barrettov pažerák pozostával z metaplázie, v ktorej boli normálne bunky lemujúce pažerák nahradené zmesou buniek žalúdočnej a črevnej výstelky. Bunky výstelky črevného typu sa tiež nazývajú špecializované stĺpcové bunky, ktoré zahŕňajú pohárikové bunky. Niektorí vedci si niekoľko rokov mysleli, že existujú dva typy Barrettovej choroby; jeden, v ktorom bola normálna výstelka nahradená len bunkami žalúdočného (žalúdočného) typu, a druhý, v ktorom boli prítomné črevné bunky. V súčasnosti sa však verí, že iba prítomnosť pohárikovitých buniek črevného typu stanovuje diagnózu Barrettovho pažeráka bez ohľadu na to, aké iné typy buniek sú prítomné.
Dôvodom veľkého záujmu o Barrettov pažerák je, že sa spája so zvýšeným rizikom rakoviny pažeráka. Typ rakoviny, ktorý sa vyskytuje u pacientov s Barrettovou chorobou, je adenokarcinóm, ktorý vzniká z metaplastického črevného tkaniva. Zvyčajná rakovina pažeráka, ktorá nie je spojená s Barrettovou chorobou, je skvamózny karcinóm, ktorý vzniká zo skvamóznej bunkovej výstelky, ktorá je normálne prítomná v pažeráku. Spojenie medzi adenokarcinómom pažeráka a Barrettovým pažerákom je teraz jasné a výskyt adenokarcinómu pažeráka sa zvyšuje vo väčšine krajín západnej pologule.
Dobrou správou však je, že rakovina sa vyskytuje u relatívne malého počtu pacientov s Barrettovým pažerákom. Napriek tomu je hlavnou výzvou v tomto stave sledovať včasné varovné príznaky rakoviny odoberaním biopsií v pravidelných intervaloch počas endoskopie. Tento postup sa nazýva dohľad a je v princípe podobný dohľadu u žien pri rakovine krčka maternice, pri ktorom sa v pravidelných intervaloch odoberajú PAP stery.
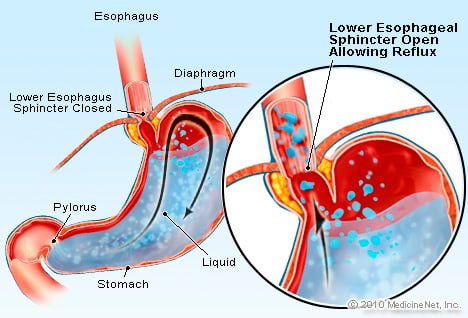
 GERD je stav, pri ktorom nadmerná tekutina obsahujúca kyselinu refluxuje (tečie) späť do pažeráka, čiastočne preto, dolný pažerákový zvierač je slabý.
GERD je stav, pri ktorom nadmerná tekutina obsahujúca kyselinu refluxuje (tečie) späť do pažeráka, čiastočne preto, dolný pažerákový zvierač je slabý. GERD spôsobuje Barrettov pažerák. Pažerák je svalová trubica, ktorá sa nachádza v hrudníku a slúži na prenos potravy z úst do žalúdka. Dolný pažerákový zvierač (LES) je chlopňa, ktorá sa nachádza na križovatke žalúdka s pažerákom. Jeho funkciou je zabrániť vracaniu kyseliny a iného obsahu žalúdka späť do pažeráka. GERD je stav, pri ktorom nadmerná tekutina obsahujúca kyselinu refluxuje (tečie) späť do pažeráka, čiastočne preto, že dolný pažerákový zvierač je slabý. Slabosť LES môže čiastočne súvisieť so skutočnosťou, že prakticky všetci pacienti s GERD majú hiátovú herniu. U pacientov s hiátovou herniou sa horných pár centimetrov žalúdka posúva cez bránicu tam a späť medzi brucho a hrudník. Toto posúvanie môže interferovať s tým, ako zvierač funguje ako bariéra proti refluxu zo žalúdka do pažeráka.
Predtým sa termín kýla používal namiesto GERD pri vysvetľovaní pacientovho základu ich symptómov (zvyčajne pálenia záhy), pretože prakticky všetci pacienti s GERD majú hiátovú herniu. GERD je však presnejší termín. Zatiaľ čo hiátová hernia je v populácii extrémne bežná, len u malého počtu ľudí s hiátovou herniou sa vyvinie GERD. Inými slovami, prítomnosť hiátovej hernie neznamená, že sa u osoby vyvinie GERD. Na druhej strane, ak má človek GERD, hiátová hernia je takmer vždy prítomná.
Barrettov pažerák je teda spôsobený chronickým (veľa rokov trvajúcim) a zvyčajne závažným refluxom kyseliny. U niektorých pacientov s GERD pažerák reaguje na opakované poškodenie kyslou tekutinou zmenou typu buniek, ktoré ho lemujú, zo skvamóznych (normálne bunky) na cylindrické (bunky črevného typu). Táto transformácia, nazývaná metaplázia, sa považuje za protektívnu reakciu, pretože špecializovaný stĺpcový epitel (epitel znamená výstelku) v Barrettovom pažeráku je odolnejší voči poškodeniu kyselinou ako dlaždicový epitel.
Tekutina v žalúdku obsahuje kyselinu, ktorú produkuje žalúdok. Okrem toho však tekutina môže obsahovať žlčové kyseliny (zo žlče produkovanej pečeňou) a enzýmy (produkované pankreasom), ktoré sa spätne vrátili z dvanástnika do žalúdka. (Dvanástnik je prvá časť tenkého čreva hneď za žalúdkom.) Kyselina, ktorá sa refluxuje zo žalúdka do pažeráka, je pre pažerák škodlivá. Existujú však určité dôkazy, že žlčové a pankreatické enzýmy v kombinácii s kyselinou môžu byť škodlivejšie ako samotná kyselina.
U významného percenta jedincov s chronickými príznakmi GERD sa vyvinie Barrettov pažerák a je najbežnejší v kaukazskej mužskej populácii. Nie každý s GERD má však príznaky GERD. Niektorí ľudia s Barrettovou chorobou si preto neuvedomujú, že majú Barrettovu chorobu, pretože majú GERD bez akýchkoľvek príznakov alebo majú veľmi mierne a zriedkavé príznaky.
Nie je jasné, prečo je Barrettov pažerák tak výrazne častejší u bielych mužov ako v ktorejkoľvek inej skupine. Napríklad, hoci sa zdá, že ženy a Afroameričania nie sú chránení pred rozvojom GERD, sú do značnej miery chránení (najmä Afroameričania) pred rozvojom Barrettovho pažeráka a Barrettovej rakoviny (adenokarcinóm). Existujú dôkazy, že na západnej pologuli sa frekvencia rakoviny pažeráka a rakoviny gastroezofageálneho spojenia (nazývaná rakovina srdca) zvyšuje, možno viac ako ktorákoľvek iná rakovina gastrointestinálneho traktu. (Rakovina hrubého čreva je však stále oveľa bežnejšia ako rakovina pažeráka.)
Barrettov pažerák môže v niektorých rodinách prebiehať a byť geneticky podmienený. Prebiehajú štúdie, aby sa zistilo, či sa v týchto rodinách dajú nájsť nejaké gény alebo markery, ktoré by predpovedali vývoj Barrettovho pažeráka v bežnej populácii. V týchto rodinách s Barrettovou, ako aj s Barrettovou v bežnej populácii je GERD spoločným menovateľom. Otázkou však je, prečo sa Barrettova choroba vyskytuje častejšie v týchto rodinách ako v iných s porovnateľne ťažkou GERD, ale bez rodinnej asociácie.
Opakujem, prvým kritériom pre diagnózu Barrettovho pažeráka je endoskopický nález ružovej výstelky v pažeráku, kde ju bežne nevidieť. Táto abnormálna výstelka sa môže po obvode javiť ako pás, jazyk alebo ako ostrovčeky. Druhým kritériom je, že biopsie z ružovej výstelky odhalia charakteristickú črevnú sliznicu (výstelku bežne viditeľnú v črevách) s typickými pohárikovitými bunkami. Ezofageálne biopsie sa získavajú počas endoskopie. Endoskopia hornej časti gastrointestinálneho traktu je postup, pri ktorom lekár vloží dlhú ohybnú trubicu (endoskop) cez ústa a dole do pažeráka, aby priamo vizualizoval výstelku pažeráka. Počas toho istého endoskopického vyšetrenia je možné vizualizovať aj žalúdok a dvanástnik. Viacnásobné malé vzorky (biopsie) výstelkového epiteliálneho tkaniva možno získať prostredníctvom endoskopu.
Ako už bolo spomenuté, proces nahradenia jedného typu tkanivovej výstelky iným sa nazýva metaplázia. V žalúdku a črevách je metaplázia bežnou odpoveďou na určité typy poranení. Ako uviedol patológ Henry Appelman:"Keď je črevo v strese, chce byť niečím iným." Ďalšie príklady metaplázie, pri ktorej jedna výstelka nahrádza druhú, sú:(1) v žalúdku, kde chronický zápal (gastritída) môže viesť k výmene častí normálnej výstelky žalúdka výstelkou črevného typu; a (2) v dvanástniku (hneď za žalúdkom v čreve), kde sa vyskytujú peptické vredy a črevná výstelka obklopujúca vred sa transformuje na výstelku žalúdočného typu.
Domnievame sa, že proces metaplázie je ochranná alebo adaptívna reakcia na poranenie výstelky. Nevýhodou metaplázie je však to, že v Barrettovom pažeráku nesie malé, ale jednoznačné zvýšenie rizika rakoviny. Nie všetky metaplázie majú zvýšené riziko rakoviny. Napríklad z dvoch metaplázií uvedených v predchádzajúcom odseku môže črevná metaplázia v žalúdku viesť k rakovine, ale intestinálna metaplázia v dvanástniku nie.
Proces vývoja Barrettovho syndrómu začína na križovatke žalúdka a pažeráka. Pažerák je normálne vystlaný skvamóznym epitelom alebo výstelkovou vrstvou. Tento skvamózny epitel má perleťovo biely vzhľad, zatiaľ čo výstelka v žalúdku a črevách má viac lososovo ružovú farbu, pretože je to skôr stĺpcový epitel než skvamózny epitel. Skvamózny epitel je tvorený plochými dlaždicovými bunkami, ktoré sú podobné bunkám kože. Žalúdočná alebo žalúdočná výstelka pozostáva z vyšších stĺpcových buniek, ako je vidieť pod mikroskopom. Spojenie dlaždicového epitelu pažeráka a stĺpcového epitelu žalúdka sa vyskytuje na križovatke pažeráka a žalúdka, kde sa, ako si pamätáte, nachádza dolný zvierač pažeráka. Spoločná hranica (rozhranie) týchto dvoch výsteliek sa často označuje ako čiara Z, pretože pri endoskopickom vyšetrení má cik cak vzhľad.
S progresívnym poranením pažeráka dochádza k metaplázii a metaplastické tkanivo sa pohybuje hore pažerákom na vzdialenosť, ktorá sa mení od človeka k človeku, zvyčajne od asi 0,5 do 2,5 palca (asi 1 až 6 centimetrov). Typ bunky, z ktorej vzniká metaplastické tkanivo, nie je známy.
Barrettov pažerák je často kategorizovaný do Barrettovho pažeráka s krátkym alebo dlhým segmentom na základe dĺžky pažeráka, ktorý je postihnutý. Krátky segment Barrettov sa vo všeobecnosti týka postihnutia 3 cm alebo menej, zatiaľ čo dlhý segment znamená postihnutie pažeráka viac ako 3 cm. Je zaujímavé, že akonáhle je u pacienta diagnostikovaný Barrettov pažerák, zdá sa, že metaplastická výstelka nepostupuje ďalej do pažeráka, ak sa pacient lieči na GERD. V priebehu času teda dĺžka zapojenia do Barrett's zostáva vo všeobecnosti rovnaká.
Ak sa odoberú biopsie od pacientov s GERD, ktorí majú normálne vyzerajúcu líniu Z (žiadny viditeľný dôkaz Barrettovho pažeráka), až 30 % bude vykazovať rovnakú metapláziu črevného typu s pohárikovitými bunkami ako tie, ktoré sa vyskytujú v Barrettovom pažeráku. Bežne však nerobíme biopsiu normálne vyzerajúcich Z línií, aby sme hľadali túto zmenu, ani nerobíme dohľad, keď ju tam nájdeme. Dôvodom je, že obmedzená intestinálna metaplázia oblasti gastroezofageálnej junkcie pri GERD sa zrejme vyskytuje s podobnou frekvenciou u žien a Afroameričanov ako u bielych mužov, avšak riziko zjavného Barrettovho pažeráka je oveľa menšie ako u bielych mužov.
Prítomnosť metaplázie pri rutinnej biopsii normálne vyzerajúcej línie Z pri GERD by preto nemala viesť k žiadnej zmene manažmentu. Ba čo viac, nález pohárikovitých buniek v tomto kontexte by nemal byť označovaný, ako niektorí navrhli, ako ultrakrátky segment Barrettov. Hlavným dôvodom, prečo nie je označený ako Barrett's, je, že výraz Barrett's znamená zvýšené riziko rakoviny a neexistuje žiadny dôkaz, že toto zistenie je spojené so zvýšeným rizikom rakoviny.
Typ rakoviny, ktorý sa vyskytuje s Barrettovým pažerákom, je adenokarcinóm. Rakovina vychádzajúca zo skvamóznej výstelky pažeráka sa nazýva skvamózna rakovina alebo karcinóm. U belochov sa miera (frekvencia v priebehu času) skvamóznej rakoviny v porovnaní s adenokarcinómom súvisiacim s Barrettom znižuje. Iné rasové skupiny (napríklad Afroameričania) však nezaznamenali rovnakú mieru poklesu skvamóznej rakoviny v porovnaní s adenokarcinómom.
Fajčenie a nadmerné požívanie alkoholu sú jednoznačnými rizikovými faktormi pre skvamóznu rakovinu. Sú tiež rizikovými faktormi pre adenokarcinóm pozorovaný v Barrettovom pažeráku. V tejto situácii však nie je jasné, či fajčenie a alkohol zvyšujú riziko adenokarcinómu tým, že robia GERD závažnejším, alebo či fajčenie a alkohol majú priamočiarejší rakovinotvorný účinok, ako sa vyskytuje pri skvamóznej rakovine. Spinocelulárne karcinómy sú čoraz menej bežné, zatiaľ čo diagnózy adenokarcinómov stúpajú. Výskyt adenokarcinómu u bielych mužov vzrástol strmšie ako u iných etnických skupín.
Vo zvyšku tejto časti sa termín rakovina pažeráka bude vzťahovať na adenokarcinóm vychádzajúci z Barrettovho pažeráka.
Rakovina gastroezofageálneho spojenia sa tiež nazýva rakovina srdca, pretože oblasť, kde sa pažerák stretáva so žalúdkom, sa nazýva kardia. Táto rakovina, podobne ako adenokarcinóm súvisiaci s Barrettom, sa vyskytuje prevažne u bielych mužov, zjavne sa frekvencia zvyšuje rovnakou rýchlosťou ako rakovina pažeráka a je spojená s chronickou GERD. Preto sa špekulovalo, že rakovina srdca začína z krátkych segmentov (napríklad 1-2 cm) Barrettovej. V čase stanovenia diagnózy rakoviny sa však nádor môže rozšíriť za krátky segment Barrettovho nádoru a môže sa zdať, že je v kardii. Túto špekuláciu o pôvode rakoviny kardie však treba ešte dokázať.
Zvýšenie frekvencie adenokarcinómu pažeráka sa pozorovalo najmenej 20 rokov, predovšetkým u bielych mužov. Jeden kľúč k dôvodu tohto trendu môže súvisieť so znížením frekvencie H. pylori infekcia žalúdka. Inými slovami, zdá sa, že ľudia s Barrettovou rakovinou, vrátane rakoviny srdca, majú nižšiu mieru H. pylori infekciu ako iní rovnakého veku a pohlavia v rovnakej populácii.
H. pylori je typ baktérie, ktorá je hlavnou príčinou vredov. Je to celosvetovo veľmi bežná infekcia a u veľkej väčšiny postihnutých ľudí nespôsobuje žiadne príznaky. Avšak niektorí ľudia s H. pylori vyvinúť peptický vred žalúdka a dvanástnika. Tieto vredy sa liečia elimináciou baktérií, čo zase zabraňuje recidíve vredov.
Ak H. pylori ak sa nelieči, spôsobuje progresívny zápal žalúdka (gastritída), ktorý je spojený so znížením sekrécie kyseliny a možno aj menším spätným tokom kyseliny do pažeráka. V mnohých oblastiach sveta sa frekvencia tejto infekcie znižuje, pravdepodobne kvôli lepším opatreniam v oblasti verejného zdravia. Preto je možné, že ochranný účinok (ako je znížená tvorba kyseliny) chronickej H. pylori infekcia sa znížila. Inými slovami, s menšou H. pylori gastritída, žalúdok produkuje viac kyseliny a je viac kyseliny na reflux do pažeráka. Zároveň sme v seniorskom veku viac náchylní na reflux. Hoci to nie je vyriešený problém, klesajúca frekvencia H. pylori infekcia môže byť jedným z dôvodov zvyšujúcej sa frekvencie Barrettovho adenokarcinómu.
Dysplázia je zmena v bunkách lemujúcich pažerák, v ktorých bunky skutočne vykazujú abnormálne zmeny vo svojej štruktúre a vzhľade. Keď sa tieto zmeny stanú dostatočne závažnými (od dysplázie nízkeho stupňa po dyspláziu vysokého stupňa), bunky sa začnú javiť ako malígne (ako rakovinové bunky). Na rozdiel od rakoviny však tieto bunky zostávajú na svojom mieste a nenapádajú tkanivá mimo výstelky. Dysplázia sa vyskytuje ako séria bunkových zmien, keď Barrettov pažerák progreduje do rakoviny spojenej s Barrettom. Pacienti s Barrettovou chorobou sú monitorovaní endoskopiou a biopsiami (dozor), aby sa zistili tieto bunkové zmeny (dysplázia) alebo v najhoršom prípade skorá rakovina, aby mohli byť liečení. V súčasnosti neexistuje spôsob, ako predpovedať, u ktorých pacientov s Barrettovým pažerákom sa rozvinie dysplázia.
Dysplázia bola tiež identifikovaná v blízkosti iných nádorov gastrointestinálneho traktu ako adenokarcinóm pažeráka. Napríklad dysplázia sa vyskytuje v polovici prípadov rakoviny žalúdka a rakoviny hrubého čreva, pri ktorej je dysplázia viditeľná ako takzvané adenomatózne polypy. Navyše, dysplázia je rovnaká zmena buniek včasného varovania, ktorú patológovia hľadajú v PAP náteroch krčka maternice, ktoré predpovedajú rakovinu krčka maternice.
Dysplázia sa považuje za premalígnu. To znamená, že ak bola dysplázia preukázaná pri viacerých príležitostiach, predpokladá sa, že pacient dostane rakovinu, ak bude žiť dostatočne dlho. Dysplázia sa kategorizuje ako vysoký alebo nízky. Keď je diagnostikovaná dysplázia vysokého stupňa, rakovina už môže byť prítomná, a ak nie, riziko vzniku rakoviny skôr je väčšie ako u dysplázie nižšieho stupňa.
Pri následných biopsiách pacientov s dyspláziou sa u niektorých pacientov tento stav nemusí znova zistiť, zatiaľ čo u iných sa zistí nízky stupeň dysplázie. Táto absencia alebo zníženie dysplázie môže byť spôsobené faktormi, ako sú variácie odberu vzoriek, odstránenie malých ložísk (skupiny buniek) dysplázie s počiatočnou biopsiou alebo skutočný biologický zvrat. Presný dôvod (príčiny) nie je známy.
Pomocou molekulárnych techník možno niektoré zmeny označované ako biomarkery detegovať v bioptických vzorkách pred rozvojom dysplázie. Tieto zmeny sú podobné tým, ktoré sa pozorujú pri iných rakovinách. Biomarkery zahŕňajú zmeny v obsahu DNA v bunkách, v génoch a chromozómoch a v rastových faktoroch. Mnohé z týchto biomarkerov sa môžu objaviť pred a počas výskytu dysplázie. Konečným cieľom je nájsť magický marker, ktorý nám môže povedať, u ktorých pacientov spomedzi pacientov bez dysplázie alebo dysplázie nízkeho stupňa je pravdepodobnejšie, že sa u nich vyvinie dysplázia vysokého stupňa alebo rakovina. Takíto pacienti potom môžu byť sledovaní dôkladnejšie ako ostatní.
V súčasnosti sú všetci pacienti s Barrettovým pažerákom z pohľadu dohľadu liečení rovnako. Dostupnosť biomarkerov by oddelila (stratifikovala) Barrettových pacientov na základe ich rizika rakoviny. Takáto stratifikácia by lekárom umožnila vykonávať dohľadovú endoskopiu a biopsie častejšie u menšiny pacientov, ktorí sú vystavení vyššiemu riziku rakoviny a menej často u tých, u ktorých sa predpokladá nižšie riziko rakoviny.
Ďalším využitím overených biomarkerov by bolo pomôcť potvrdiť patológovu interpretáciu dysplázie na biopsiách.
Keď sa pacienti s Barrettovým pažerákom hodnotia ako skupina, zistilo sa, že riziko rakoviny je tak nízke, ako jeden z 300 pacientov ročne. To znamená, že ak by sme vyšetrili 300 pacientov ročne, každý rok by sa zistilo, že jeden pacient má rakovinu. Čo skutočne potrebujeme vedieť, je riziko rakoviny, ak sa po jednom alebo dvoch rokoch sledovania nenájde žiadna dysplázia. Sme presvedčení, že toto riziko by bolo oveľa menšie ako predtým uvádzané čísla jedného z 300 pacientov ročne.
U pacientov s dyspláziou vysokého stupňa môže byť často zistené, že majú rakovinu. Preto prvou líniou liečby pri zistení dysplázie vysokého stupňa je vylúčiť prítomnosť adenokarcinómu.
Dysplázia nízkeho stupňa je oveľa menej ohrozujúca ako dysplázia vysokého stupňa, ale nevieme, o koľko menej. V skutočnosti nemáme presné údaje, ktoré by naznačovali, aké je riziko rakoviny u pacientov s Barrettovou a dyspláziou nízkeho stupňa.
Diagnóza dysplázie by mala byť čo najpresnejšia, pretože táto diagnóza môže vyvolať zmenu liečby alebo intenzity sledovania pacientov s Barrettovým pažerákom. Vyžaduje si to veľké skúsenosti, aby bolo možné presne diagnostikovať prítomnosť a stupeň dysplázie. Preto je bežnou a užitočnou praxou požiadať druhého patológa (alebo dokonca tretieho, ak je to potrebné), aby skontroloval biopsie. Cieľom je zistiť, či existuje zhoda medzi patológmi a/alebo získať skúsenejší názor na prítomnosť a stupeň dysplázie.
Ak má človek dlhší segment Barrettovho syndrómu, dalo by sa predpokladať, že riziko rakoviny je väčšie ako pri Barrettovom kratšom segmente. Údaje sú však v tomto smere kontroverzné. Z tohto dôvodu je súčasnou praxou vykonávať endoskopickú biopsiu s podobnou frekvenciou u pacientov s krátkym a dlhým segmentom Barrettovho pažeráka.
Barrettov pažerák nemá žiadne jedinečné príznaky. Pacienti s Barrettovou chorobou majú príznaky GERD (napríklad pálenie záhy, regurgitácia, nevoľnosť atď.). Všeobecným trendom je, že Barrettovi pacienti majú závažnejšiu GERD. Nie všetci Barrettovi však majú výrazné príznaky GERD a niektorí pacienti sú náhodne zistení s minimálnymi alebo žiadnymi príznakmi GERD.
Pálenie záhy je pocit pálenia za hrudnou kosťou, zvyčajne v dolnej polovici, ale môže siahať až po hrdlo. Niekedy je sprevádzané pálením alebo bolesťou v žalúdku tesne pod miestom, kde končí hrudná kosť. Druhým najčastejším príznakom je regurgitácia (záloha) tekutiny horkej chuti. Príznaky GERD sú často horšie po jedle a pri ležaní.
Refluxovaná, regurgitovaná tekutina sa príležitostne môže dostať do pľúc alebo hlasovej schránky (hrtanu), čo má za následok takzvané extraezofageálne (mimo pažerák) symptómy (prejavy) GERD. Tieto príznaky zahŕňajú:
Z dôvodov, ktoré nie sú úplne pochopené, niektorí pacienti s GERD majú minimálne pálenie záhy, ale pociťujú iné symptómy GERD, napríklad extraezofageálne symptómy.
GERD môže viesť k striktúram a ulcerácii pažeráka. Striktúra alebo zúženie je spôsobené zjazvením (fibrózou) pažeráka, ktoré môže spôsobiť ťažkosti s prehĺtaním (dysfágia). Dysfágia je vnímaná ako prilepenie (zastavenie) tuhej potravy v hrudníku (v pažeráku) a tekutín, keď je zúženie závažné. Striktúry je možné liečiť ich naťahovaním pomocou dilatátorov počas endoskopie. Neliečené striktúry môžu podporovať väčšie rozliatie potravy a/alebo žalúdočných tekutín do pľúc. Menej často sa môže vyskytnúť masívne gastrointestinálne (GI) krvácanie spôsobené zápalom pažeráka. Takéto krvácanie má za následok zvracanie krvi alebo prechod čiernej alebo gaštanovej stolice. Častejšie však môže zapálený pažerák spôsobiť pomalé krvácanie, ktoré sa zistí pri zistení anémie (nízky počet červených krviniek) a/alebo pri testovaní stolice na krv.
Medikamentózna liečba symptómov Barrettovho pažeráka je rovnaká ako liečba GERD.
Potlačenie kyseliny je základom liečby GERD. Pri miernych príznakoch refluxu sa bežne používajú voľnopredajné lieky, od antacíd až po nízke dávky liekov nazývaných antagonisty H-2 receptora alebo H2 blokátory. Príkladmi voľne predajných H2 blokátorov sú cimetidín (Tagamet) a famotidín (Pepcid, Zantac 360). Pre trvalejšie symptómy sa môžu použiť vyššie (na predpis) dávky antagonistov H-2 receptora, napríklad:
Pri pretrvávajúcich symptómoch vyžadujúcich udržiavaciu (pretrvávajúcu) liečbu alebo pri komplikovanej GERD so striktúrami alebo krvácaním sa však používajú inhibítory protónovej pumpy (PPI). Príklady PPI sú:
Niektorí pacienti potrebujú užívať iba jednu tabletku denne, zatiaľ čo iní potrebujú na kontrolu symptómov dve tabletky (dvojitá dávka). Dvojitá dávka sa môže užiť ako jedna tableta dvakrát denne alebo 2 tabletky jedenkrát denne.
PPI sú silné inhibítory sekrécie kyseliny zo žalúdka. Sú účinné pri zmierňovaní pálenia záhy a hojení zápalu pažeráka (ezofagitídy) a pažerákových vredov, ktoré sú vyvolané refluxom kyseliny. IPP sú dobre tolerované s malým počtom vedľajších účinkov. Po vysadení týchto liekov sa príznaky refluxu kyseliny zvyčajne opakujú, niekedy so zvýšenou intenzitou. K tomuto zvýšeniu symptómov dochádza čiastočne v dôsledku spätnej sekrécie kyseliny (hypersekrécia kyseliny), čo je odpoveď vyvolaná zotavením sa z inhibície sekrécie kyseliny prostredníctvom PPI.
Dlhodobá bezpečnosť IPP je dôležitým faktorom. Although certain stomach tumors (carcinoids) were reported in experiments with older female rats, similar tumors have not been observed in people after more than 15 years of PPI use. In some people on long-term PPI therapy, small benign polyps (fundic gland polyps) may develop in the upper half of the stomach. However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. Patria sem:
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found
Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
 Zbavte sa tréningových kolies SCD vytvorením zóny bezpečnej pre potraviny
Čo sa stane, keď chýba základ? Tie maličkosti, ktoré často zavrhujeme ako nedôležité... Čo keby ste sa napríklad pokúsili jazdiť na bicykli bez toho, aby ste si najprv zdokonalili svoje zručnosti na
Zbavte sa tréningových kolies SCD vytvorením zóny bezpečnej pre potraviny
Čo sa stane, keď chýba základ? Tie maličkosti, ktoré často zavrhujeme ako nedôležité... Čo keby ste sa napríklad pokúsili jazdiť na bicykli bez toho, aby ste si najprv zdokonalili svoje zručnosti na
 Sprievodca vianočnými darčekmi SIBO
Nakupovanie vianočných darčekov pre niekoho s premnožením baktérií v tenkom čreve, syndrómom dráždivého čreva alebo s akoukoľvek inou črevnou poruchou sa môže zdať zdrvujúce. Zostavili sme spätnú väzb
Sprievodca vianočnými darčekmi SIBO
Nakupovanie vianočných darčekov pre niekoho s premnožením baktérií v tenkom čreve, syndrómom dráždivého čreva alebo s akoukoľvek inou črevnou poruchou sa môže zdať zdrvujúce. Zostavili sme spätnú väzb
 Aké sú príznaky nezdravého čreva?
Jedlo je palivo. Zdravé črevá rozložia potravu do jednoduchej formy, aby zásobili krvný obeh a telo živinami. Zdravé črevá tiež pomôžu chrániť vaše telo pred baktériami, vírusmi a plesňami. Bude komun
Aké sú príznaky nezdravého čreva?
Jedlo je palivo. Zdravé črevá rozložia potravu do jednoduchej formy, aby zásobili krvný obeh a telo živinami. Zdravé črevá tiež pomôžu chrániť vaše telo pred baktériami, vírusmi a plesňami. Bude komun