 A GERD-ben szenvedő betegek 10%-ában alakul ki Barrett-nyelőcső, amely a nyelőcsőrák kockázati tényezője.
A GERD-ben szenvedő betegek 10%-ában alakul ki Barrett-nyelőcső, amely a nyelőcsőrák kockázati tényezője.

A Barrett-nyelőcsőnek nincsenek egyedi tünetei. A Barrett-kóros betegeknél a GERD vagy savas reflux tünetei a következők:
A Barrett-nyelőcső a krónikus gastrooesophagealis reflux betegség (GERD) szövődménye, elsősorban fehér férfiaknál. A GERD egy olyan betegség, amelyben a savas folyadék a gyomorból a nyelőcsőbe (a nyelőcsőbe) jut vissza. A GERD leggyakrabban gyomorégést okoz.
A Barrett-nyelőcső diagnózisának két követelménye van. A követelmények a nyelőcső endoszkópiáját teszik szükségessé. Az endoszkópia során egy hosszú hajlékony csövet fénnyel és a végén kamerával (endoszkópot) helyeznek be a szájon keresztül a nyelőcsőbe, hogy megtekintsék és biopsziázzák (szövetmintát) a nyelőcső nyálkahártyájából. A két követelmény a következő:
A Barrett-nyelőcsövet a Kongresszusi Könyvtár hivatalosan Barrett-nyelőcsőként kódolta az irodalomban végzett elektronikus keresésekhez, de a Barrett-nyelőcső ("s" aposztrófával) az univerzálisan használt név. Az állapotot Norman Barrett sebészről nevezték el, aki leírta az állapotot. Kiderült azonban, hogy a megállapítások értelmezése nem volt helyes. 1953-ban Doctors' Allison és Johnstone tulajdonképpen úgy írták le ezt az állapotot, ahogyan ma értjük, nevezetesen, hogy metaplasia fordul elő. (A metaplasia, amelyet alább tárgyalunk, akkor használatos, amikor egy felnőtt szövet egy másikat vált fel.) Ennek ellenére az állapotot Barrett nevével örökítették meg.
Kezdetben úgy gondolták, hogy a Barrett-nyelőcső gyomor (gyomor) szövetből áll, amely felváltja a nyelőcsövet borító szokásos laphámszövetet. Azonban a 70-es évek közepén Dr. Paull és munkatársai publikáltak egy tanulmányt, amelyben részletesebben írták le a Barrett-nyelőcső nyálkahártyáját (belső bélését), mint korábban. Rámutattak arra, hogy a Barrett-nyelőcsövet egy metaplázia alkotja, amelyben a nyelőcsövet bélelő normális sejteket a gyomor és a bélrendszert bélelő sejtek keveréke váltotta fel. A bél típusú béléssejteket speciális oszlopos sejteknek is nevezik, amelyek magukban foglalják a serlegsejteket. Néhány tudós évekig úgy gondolta, hogy a Barrett-kórnak két típusa létezik; az egyik, amelyben a normál bélést csak gyomor (gyomor) típusú sejtekkel helyettesítették, a másikban pedig bélsejtek voltak jelen. A jelenlegi vélekedés azonban az, hogy csak a bélrendszeri típusú kehelysejtek jelenléte alapozza meg a Barrett-nyelőcső diagnózisát, függetlenül attól, hogy milyen más sejttípusok vannak jelen.
A Barrett-nyelőcső iránti nagy érdeklődés oka az, hogy összefüggésbe hozható a nyelőcsőrák fokozott kockázatával. A Barrett-kóros betegeknél előforduló ráktípus az adenokarcinóma, amely a metaplasztikus bélszövetből származik. A nyelőcső szokásos rákja, amely nem társul a Barrett-kórhoz, a laphámrák, amely a nyelőcsőben általában jelenlévő laphámsejt-bélésből származik. A nyelőcső adenokarcinóma és a Barrett-nyelőcső közötti kapcsolat mára egyértelmű, és a nyelőcső adenokarcinóma egyre gyakoribb a nyugati félteke legtöbb országában.
A jó hír azonban az, hogy a rák viszonylag kevés Barrett-nyelőcsőben szenvedő betegnél fordul elő. Ennek ellenére a fő kihívás ebben az állapotban a rák korai figyelmeztető jeleinek figyelése az endoszkópia során rendszeres időközönkénti biopsziák vételével. Ezt a gyakorlatot felügyeletnek nevezik, és elvileg hasonló a nők méhnyakrákos megfigyeléséhez, ahol rendszeres időközönként PAP-kenetet vesznek.
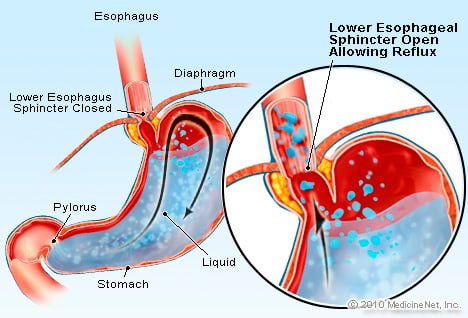
 A GERD olyan állapot, amelyben a túlzott mennyiségű savtartalmú folyadék visszafolyik (folyik) vissza a nyelőcsőbe, részben azért, mert a nyelőcső alsó záróizma gyenge.
A GERD olyan állapot, amelyben a túlzott mennyiségű savtartalmú folyadék visszafolyik (folyik) vissza a nyelőcsőbe, részben azért, mert a nyelőcső alsó záróizma gyenge. A GERD okozza a Barrett-nyelőcsövet. A nyelőcső egy izmos cső, amely a mellkasban található, és arra szolgál, hogy a táplálékot a szájból a gyomorba szállítsa. Az alsó nyelőcső-záróizom (LES) egy szelep, amely a gyomor és a nyelőcső találkozásánál található. Feladata, hogy megakadályozza, hogy a gyomor sav és egyéb tartalma visszajusson a nyelőcsőbe. A GERD olyan állapot, amelyben a túlzott savtartalmú folyadék visszafolyik (áram) a nyelőcsőbe, részben azért, mert a nyelőcső alsó záróizma gyenge. A LES gyengesége részben összefügghet azzal a ténnyel, hogy gyakorlatilag minden GERD-betegnek van hiatussérve. Hiatus herniában szenvedő betegeknél a gyomor felső néhány centimétere oda-vissza csúszik a has és a mellkas között a membránon keresztül. Ez a csúszás megzavarhatja a záróizom működését a gyomorból a nyelőcsőbe történő visszafolyás gátjaként.
Korábban a GERD helyett a sérv kifejezést használták a betegeknek tüneteik (általában gyomorégés) magyarázatára, mivel gyakorlatilag minden GERD-betegnek van hiatusherniája. A GERD azonban a pontosabb kifejezés. Míg a hiatus sérv rendkívül gyakori a lakosság körében, csak kis számú hiatus sérv alakul ki GERD-ben. Más szóval, a hiatus hernia jelenléte nem jelenti azt, hogy az illetőnél GERD alakul ki. A másik oldalon azonban, ha valakinek GERD-je van, a hiatus hernia szinte mindig jelen van.
Így a Barrett-nyelőcsövet krónikus (sok éven át tartó) és általában súlyos savas reflux okozza. Egyes GERD-ben szenvedő betegeknél a nyelőcső a savas folyadék által okozott ismételt sérülésre úgy reagál, hogy megváltoztatja a bélelő sejteket laphámról (normál sejtek) oszloposra (bél típusú sejtek). Úgy gondolják, hogy ez az átalakulás, amelyet metapláziának neveznek, védőreakció, mivel a Barrett-nyelőcső speciális oszlopos hámja (az epithelium azt jelenti, hogy bélés) jobban ellenáll a sav okozta sérüléseknek, mint a laphám.
A gyomorban lévő folyadék savat tartalmaz, amelyet a gyomor termel. Ezen kívül azonban a folyadék tartalmazhat epesavat (a máj által termelt epéből) és enzimeket (a hasnyálmirigy termel), amelyek a nyombélből visszafolytak a gyomorba. (A nyombél a vékonybél első része, közvetlenül a gyomor mögött.) A gyomorból a nyelőcsőbe visszafolyó sav káros a nyelőcsőre. Vannak azonban bizonyítékok arra vonatkozóan, hogy az epe- és hasnyálmirigy enzimek a savval kombinálva károsabbak lehetnek, mint a sav önmagában.
A GERD krónikus tüneteit mutató egyének jelentős százalékánál Barrett-nyelőcső alakul ki, és ez a leggyakoribb a kaukázusi férfipopulációban. Azonban nem mindenkinek, aki GERD-ben szenved, vannak GERD tünetei. Ezért néhány Barrett-kórban szenvedő ember nincs tudatában annak, hogy Barrett-kórban szenved, mert GERD-je van, tünet nélkül, vagy nagyon enyhe és ritka tüneteik vannak.
Nem világos, hogy a Barrett-nyelőcső miért olyan elsöprően gyakoribb a fehér férfiaknál, mint bármely más csoportban. Például, bár úgy tűnik, hogy a nők és az afro-amerikaiak nincsenek védettek a GERD kialakulásával szemben, nagyrészt védettek (különösen az afro-amerikaiak) a Barrett-nyelőcső és a Barrett-rák (adenokarcinóma) kialakulásától. Bizonyítékok vannak arra vonatkozóan, hogy a nyugati féltekén a nyelőcsőrák és a gyomor-nyelőcső csomópontjának rákja (úgynevezett cardiarák) növekszik, talán gyakrabban, mint bármely más gyomor-bélrendszeri rák. (A vastagbélrák azonban még mindig sokkal gyakoribb, mint a nyelőcsőrák.)
A Barrett-nyelőcső előfordulhat bizonyos családokban, és genetikailag meghatározott. Folynak a vizsgálatok annak megállapítására, hogy ezekben a családokban található-e olyan gén vagy marker, amely előre jelezné a Barrett-nyelőcső kialakulását az általános populációban. Ezekben a Barrett-kóros családokban, valamint az általános populációban a Barrett-kóros családokban a GERD a közös nevező. A kérdés azonban az, hogy a Barrett-kór miért fordul elő gyakrabban ezekben a családokban, mint más, hasonló súlyosságú GERD-ben szenvedőkben, de nincs családi kapcsolat.
Ismétlem, a Barrett-nyelőcső diagnózisának első kritériuma az endoszkópia során a nyelőcsőben található rózsaszín nyálkahártya megtalálása, ahol általában nem látható. Ez a kóros bélés a kerület mentén sávként, nyelvszerűen vagy szigetként jelenhet meg. A második kritérium az, hogy a rózsaszín bélésből vett biopsziák feltárják a jellegzetes bélrendszeri nyálkahártyát (a belekben általában látható bélést) a tipikus serlegsejtekkel. A nyelőcső biopsziát endoszkópia során veszik. A felső gasztrointesztinális endoszkópia egy olyan eljárás, amelyben az orvos egy hosszú hajlékony csövet (endoszkópot) helyez a szájon keresztül a nyelőcsőbe, hogy közvetlenül megjelenítse a nyelőcső nyálkahártyáját. Ugyanezen endoszkópos vizsgálat során a gyomor és a nyombél is láthatóvá válik. Az endoszkópon keresztül több kis minta (biopszia) nyerhető a bélés epiteliális szövetéből.
Amint azt korábban említettük, metaplasiának nevezik azt a folyamatot, amikor az egyik típusú szövetbélés egy másikkal helyettesítődik. A gyomorban és a belekben a metaplázia gyakori válasz bizonyos típusú sérülésekre. Ahogy Henry Appelman, egy patológus kijelentette:"Amikor a bélrendszer stressz alatt van, valami más akar lenni." További példák a metapláziára, amelyben az egyik nyálkahártya helyettesíti a másikat:(1) a gyomorban, ahol a krónikus gyulladás (gasztritisz) bélrendszeri típusú nyálkahártyát eredményezhet, amely a normál gyomornyálkahártya részeit helyettesíti; és (2) a nyombélben (közvetlenül a gyomoron túl a bélben), ahol peptikus fekélyek fordulnak elő, és a fekélyt körülvevő bélnyálkahártya gyomor-típusú bélésré alakul át.
Úgy gondoljuk, hogy a metaplasia folyamata védő vagy adaptív válasz a bélés sérülésére. A metaplasia hátulütője azonban az, hogy Barrett nyelőcsövében kismértékben, de határozottan növeli a rákos megbetegedések kockázatát. Nem minden metaplázia növeli a rák kockázatát. Például az előző bekezdésben említett két metaplázia közül a gyomorban kialakuló bél-metaplasia rákhoz vezethet, a duodenumban kialakuló bél-metaplázia viszont nem.
A Barrett-kór kialakulásának folyamata a gyomor és a nyelőcső nyálkahártyájának találkozásánál kezdődik. A nyelőcsövet általában laphám vagy bélésréteg béleli. Ez a laphám gyöngyházfehér megjelenésű, míg a gyomor és a belek bélése lazacrózsaszín színű, mivel inkább oszlopos hám, mint laphám. A laphám lapos laphámsejtekből áll, amelyek hasonlóak a bőrsejtekhez. A gyomor vagy a gyomor nyálkahártyája a mikroszkóp alatt látható magasabb oszlopos sejtekből áll. A nyelőcső laphámjának és a gyomoroszlophámnak a találkozási pontja a nyelőcső és a gyomor találkozásánál található, ahol, mint emlékszik, a nyelőcső alsó záróizomja található. E két bélés közös határát (interfészét) gyakran Z-vonalnak nevezik, mivel endoszkópos vizsgálat során cikk-cakk megjelenésű.
A nyelőcső progresszív sérülése esetén metaplázia lép fel, és a metaplasztikus szövet olyan távolságra mozog felfelé a nyelőcsőben, amely személyenként változik, általában körülbelül 0,5-2,5 hüvelyk (körülbelül 1-6 centiméter). A metaplasztikus szövetet létrehozó sejttípus nem ismert.
A Barrett-nyelőcsövet gyakran rövid vagy hosszú szegmensű Barrett-be sorolják, az érintett nyelőcső hossza alapján. A Barrett-féle rövid szegmens általában 3 centiméteres vagy annál kisebb érintettséget jelent, míg a hosszú szegmens a nyelőcső több mint 3 centiméteres érintettségét jelenti. Érdekes módon, ha egy betegnél Barrett-nyelőcsövet diagnosztizálnak, úgy tűnik, hogy a metaplasztikus bélés nem halad tovább a nyelőcsőbe, ha a beteget GERD miatt kezelik. Így az idő múlásával a Barrett-féle kapcsolat időtartama általában változatlan marad.
Ha biopsziát vesznek olyan GERD-ben szenvedő betegektől, akiknek normális megjelenésű Z-vonaluk van (nincs látható bizonyíték a Barrett-nyelőcsőre), akár 30%-uk is ugyanazt a béltípusú metapláziát mutatja serlegsejtekkel, mint a Barrett-nyelőcsőben. Azonban rutinszerűen nem biopsziázunk normálisan megjelenő Z-vonalakat, hogy megkeressük ezt a változást, és nem végezzük a megfigyelést, ha ott találjuk. Ennek az az oka, hogy a gastrooesophagealis junction régió korlátozott bél-metapláziája a GERD-ben hasonló gyakorisággal fordul elő nőknél és afroamerikaiaknál, mint fehér férfiaknál, ugyanakkor a nyilvánvaló Barrett-nyelőcső kockázata sokkal kisebb, mint a fehér férfiaknál.
Ezért a metaplázia jelenléte a GERD-ben normálisan megjelenő Z vonal rutin biopsziáján nem vezethet semmilyen változáshoz a kezelésben. Mi több, a serlegsejtek megtalálását ebben az összefüggésben nem szabad ultrarövid Barrett-szegmensnek nevezni, ahogy azt egyesek javasolták. A fő ok, amiért nem Barrett-féleként tüntetik fel, az az, hogy a Barrett kifejezés a rák megnövekedett kockázatát jelenti, és nincs bizonyíték arra, hogy ez a megállapítás összefüggésben állna a rák megnövekedett kockázatával.
A Barrett-nyelőcsőben előforduló rák típusa az adenokarcinóma. A nyelőcső laphámsodott nyálkahártyájából származó rákot laphámráknak vagy karcinómának nevezik. A kaukázusiak körében a laphámrák aránya (gyakorisága) csökken a Barrett-féle adenokarcinómához képest. Más faji csoportok (például az afro-amerikaiak) azonban nem tapasztaltak ugyanilyen arányú csökkenést a laphámrákban, mint az adenokarcinómában.
A dohányzás és a túlzott alkoholfogyasztás a laphámrákok határozott kockázati tényezője. A Barrett-nyelőcsőben megfigyelhető adenokarcinóma kockázati tényezői is. Ebben a helyzetben azonban nem világos, hogy a dohányzás és az alkohol növeli-e az adenokarcinóma kockázatát azáltal, hogy súlyosbítja a GERD-t, vagy a dohányzás és az alkohol közvetlenebb rákot okozó hatást fejt ki, mint a laphámráknál. A laphámrákok egyre ritkábban fordulnak elő, miközben az adenokarcinóma diagnózisok száma emelkedett. Az adenokarcinóma előfordulása a fehér férfiaknál meredekebben emelkedett, mint más etnikai csoportokban.
A szakasz további részében a nyelőcsőrák kifejezés a Barrett-nyelőcsőből származó adenokarcinómára vonatkozik.
A gyomor-nyelőcső csomópontjának rákot cardiaráknak is nevezik, mert azt a területet, ahol a nyelőcső találkozik a gyomorral, cardiának nevezik. Ez a rák, akárcsak a Barrett-asszociált adenokarcinóma, túlnyomórészt fehér férfiakban fordul elő, láthatóan a nyelőcsőrákhoz hasonló ütemben növekszik, és krónikus GERD-hez kapcsolódik. Ezért azt feltételezték, hogy a szívrák a Barrett-féle rövid (például 1-2 cm-es) szegmensekből indul ki. Mire azonban a rák diagnózisát felállítják, a daganat túlterjedhet a Barrett-féle rövid szakaszon, és úgy tűnhet, hogy a kardiában van. A szívrák eredetére vonatkozó spekuláció azonban még bizonyításra vár.
A nyelőcső adenokarcinóma gyakoriságának növekedését figyelték meg legalább 20 éve, elsősorban fehér férfiaknál. A tendencia okának egyik nyoma a H gyakoriságának csökkenésével hozható összefüggésbe. pylorit a gyomor fertőzése. Más szavakkal, a Barrett-rákban szenvedőknél, beleértve a szívrákot is, úgy tűnik, hogy alacsonyabb a H. pylorit fertőzés, mint az azonos korú és neműek ugyanabban a populációban.
H. pylori a baktériumok egyik fajtája, amely a fekélyek fő okozója. Nagyon gyakori fertőzés világszerte, és az érintettek túlnyomó többségénél nem okoz tüneteket. Néhány ember azonban H. pylorit gyomor- és nyombélfekély alakul ki. Ezeket a fekélyeket a baktériumok eltávolításával kezelik, ami viszont megakadályozza a fekélyek visszaesését.
Ha H. pylorit Kezelés nélkül progresszív gyomorgyulladást (gastritist) okoz, amely a savszekréció csökkenésével és esetleg a nyelőcsőbe való visszaáramlás csökkenésével jár. A világ számos területén csökken a fertőzés gyakorisága, feltehetően a jobb közegészségügyi intézkedések miatt. Ezért lehetséges, hogy a védőhatás (például csökkent savtermelés) a krónikus H. pylorit a fertőzés csökkent. Más szóval, kevesebb H-val. pylorit gyomorhurut esetén a gyomor több savat termel, és több sav jut vissza a nyelőcsőbe. Ugyanakkor idősebb korunkban hajlamosabbak vagyunk a refluxra. Bár ez nem megoldott probléma, a H csökkenő gyakorisága. pylorit fertőzés lehet az egyik oka a Barrett-asszociált adenokarcinóma növekvő gyakoriságának.
A diszplázia a nyelőcsövet bélelő sejtekben bekövetkező változás, amelyben a sejtek szerkezetében és megjelenésében ténylegesen abnormális változásokat mutatnak. Amikor ezek a változások elég súlyossá válnak (alacsony fokú diszpláziáról magas fokú diszpláziára megy át), a sejtek rosszindulatúnak tűnnek (mint a rákos sejtek). A rákkal ellentétben azonban ezek a sejtek a helyükön maradnak, és nem hatolnak be a bélésen kívüli szövetekbe. A diszplázia sejtelváltozások sorozataként jelentkezik, amikor a Barrett-nyelőcső Barrett-hez kapcsolódó rákká fejlődik. A Barrett-kórban szenvedő betegeket endoszkópiával és biopsziával (megfigyeléssel) monitorozzák, hogy észleljék ezeket a sejtelváltozásokat (a diszpláziát), vagy a legrosszabb esetben a korai rákot, hogy kezelni lehessen őket. Jelenleg nincs mód annak előrejelzésére, hogy mely Barrett-nyelőcsőben szenvedő betegeknél alakul ki diszplázia.
Diszpláziát is azonosítottak a gyomor-bél traktus daganatai mellett, kivéve a nyelőcső adenokarcinómáját. Például diszplázia a gyomorrák és a vastagbélrák eseteinek felében fordul elő, amelyekben a diszplázia úgynevezett adenomatosus polipokként látható. Ezenkívül a diszplázia ugyanaz a korai előrejelző sejtelváltozás, amelyet a patológusok a méhnyakrákot előrejelző PAP-kenetekben keresnek.
A diszpláziát premalignusnak tekintik. Ez azt jelenti, hogy ha a diszpláziát többször is kimutatták, akkor feltételezhető, hogy a betegnél rákos lesz, ha elég sokáig él. A diszpláziát magas vagy alacsony fokozatú kategóriába sorolják. Ha magas fokú diszpláziát diagnosztizálnak, a rák már jelen lehet, és ha nem, akkor nagyobb a kockázata annak, hogy hamarabb alakul ki rák, mint a kisebb fokú diszplázia esetén.
A diszpláziás betegek nyomon követéses biopsziáján egyes betegeknél előfordulhat, hogy az állapotot nem észlelik újra, míg másokban alacsony fokú diszpláziát találnak. A diszplázia hiánya vagy csökkenése olyan tényezőknek tudható be, mint a mintavételi eltérések, a diszplázia apró gócainak (sejtcsoportjainak) eltávolítása a kezdeti biopsziával vagy a tényleges biológiai visszafordítás. A pontos ok(ok) nem ismertek.
Molekuláris technikák alkalmazásával néhány biomarkernek nevezett változás kimutatható a biopsziás mintákban, mielőtt a diszplázia kialakulna. Ezek a változások hasonlóak az egyéb rákos megbetegedések esetén megfigyeltekhez. A biomarkerek közé tartoznak a sejtek DNS-tartalmának, a gének és kromoszómák, valamint a növekedési faktorok változásai. Számos ilyen biomarker kimutatható a diszplázia előfordulása előtt és alatt. A végső cél egy mágikus marker megtalálása, amely meg tudja mondani, hogy a diszpláziával nem rendelkező vagy alacsony fokú diszpláziában szenvedők közül mely betegeknél alakul ki nagyobb valószínűséggel magas fokú diszplázia vagy rák. Az ilyen betegeket ezután szorosabban lehet megfigyelni, mint másokat.
Jelenleg minden Barrett-nyelőcsőben szenvedő beteget felügyeleti szempontból azonos módon kezelnek. A biomarkerek elérhetősége elkülönítené (rétegezné) a Barrett-betegeket a rák kockázata alapján. Az ilyen rétegződés lehetővé tenné az orvosok számára, hogy gyakrabban végezzenek felügyeleti endoszkópiát és biopsziát azon betegek kisebbségénél, akiknél nagyobb a rák kockázata, és ritkábban azoknál, akiknél alacsonyabb a rák kockázata.
A bizonyított biomarkerek másik felhasználási módja az, hogy segítsen megerősíteni a patológus dysplasia-értelmezését a biopsziákon.
Amikor a Barrett-nyelőcsőben szenvedő betegeket csoportként értékelik, a rák kockázatát évente 300 betegből egynél alacsonynak találták. Ez azt jelenti, hogy ha évente 300 beteget vizsgálnánk meg, évente egy betegnél derülne ki, hogy rákos. Amit igazán tudnunk kell, az a rák kockázata, ha egy-két éves megfigyelés után nem találnak diszpláziát. Meggyőződésünk, hogy ez a kockázat sokkal kisebb lenne, mint a korábban idézett adatok:évente 300 betegből egy.
A nagyfokú diszpláziában szenvedő betegeknél gyakran kiderülhet, hogy rákosak. Ezért a magas fokú diszplázia észlelésekor a kezelés első sorrendje az adenokarcinóma jelenlétének kizárása.
Az alacsony fokú diszplázia sokkal kevésbé fenyegető, mint a magas fokozatú diszplázia, de nem tudjuk, mennyivel kevésbé. Valójában nincsenek pontos adatok arra vonatkozóan, hogy mekkora a rák kockázata Barrett-kórban és alacsony fokú diszpláziában szenvedő betegeknél.
A diszplázia diagnózisának a lehető legpontosabbnak kell lennie, mert ez a diagnózis megváltoztathatja a kezelést vagy a Barrett-nyelőcsőben szenvedő betegek nyomon követésének intenzitását. A diszplázia jelenlétének és mértékének pontos diagnózisának felállítása nagy tapasztalatot igényel. Ezért általános és hasznos gyakorlat, hogy egy második patológust (szükség esetén akár egy harmadikat is) felkérnek a biopsziák áttekintésére. Az ötlet az, hogy megnézzük, van-e egyetértés a patológusok között, és/vagy tapasztaltabb véleményt kérünk a diszplázia jelenlétéről és mértékéről.
Ha egy személynek hosszabb szegmensű Barrett-kórja van, akkor azt sejtené, hogy a rák kockázata nagyobb, mint a rövidebb szegmensű Barrett-kór esetében. Az adatok azonban e tekintetben ellentmondásosak. Emiatt a jelenlegi gyakorlat az endoszkópos biopsziás megfigyelést hasonló gyakorisággal végezni a rövid és hosszú szegmensű Barrett-nyelőcsőben szenvedő betegeknél.
A Barrett-nyelőcsőnek nincsenek egyedi tünetei. A Barrett-kóros betegeknél a GERD tünetei vannak (például gyomorégés, regurgitáció, hányinger stb.). Az általános tendencia az, hogy a Barrett-betegeknél súlyosabb a GERD. Azonban nem minden Barrett-nél jelentkeznek markáns GERD-tünetek, és néhány betegnél véletlenül észlelik a GERD tüneteit minimális vagy egyáltalán nem.
A gyomorégés égő érzés a szegycsont mögött, általában az alsó felében, de egészen a torokig terjedhet. Néha égő vagy fájdalom kíséri a gyomor gödörében, közvetlenül az alatt, ahol a szegycsont véget ér. A második leggyakoribb tünet a keserű ízű folyadék regurgitációja (visszatartása). A GERD tünetei gyakran rosszabbak étkezés után és hanyatt fekve.
A visszafolyt, regurgitált folyadék esetenként bejuthat a tüdőbe vagy a hangdobozba (gége), ami a GERD úgynevezett extraesophagealis (nyelőcsövön kívüli) tüneteit (megnyilvánulásait) eredményezheti. Ezek a tünetek a következők:
Nem teljesen tisztázott okok miatt egyes GERD-betegeknél minimális a gyomorégés, de más GERD-tüneteket tapasztalnak, például extraesophagealis tüneteket.
A GERD a nyelőcső szűkületét és fekélyesedését okozhatja. A szűkületet vagy szűkületet a nyelőcső hegesedése (fibrózisa) okozza, amely nyelési nehézséget (dysphagia) okozhat. A dysphagiát a szilárd táplálék megtapadása (leállása)ként érzékeljük a mellkasban (a nyelőcsőben), és a folyadékok, amikor a szűkület erős. A szűkületek endoszkópia során tágítókkal történő nyújtással kezelhetők. A kezeletlen szűkületek elősegíthetik, hogy több étel és/vagy gyomornedv kerüljön a tüdőbe. Ritkán a nyelőcső gyulladása által okozott masszív gyomor-bélrendszeri (GI) vérzés fordulhat elő. Az ilyen vérzés vérhányást vagy fekete vagy gesztenyebarna székletet eredményez. Gyakrabban azonban a gyulladt nyelőcső lassú vérzést okozhat, amelyet vérszegénység (alacsony vörösvérsejtszám) észlelésekor és/vagy a széklet vérvizsgálatakor észlelnek.
A Barrett-nyelőcső tüneteinek orvosi kezelése megegyezik a GERD kezelésével.
A sav elnyomása a GERD kezelésének gerince. Az enyhe refluxtünetek kezelésére általában vény nélkül kapható gyógyszereket használnak, az antacidoktól a H-2 receptor antagonistáknak vagy H2-blokkolóknak nevezett gyógyszerek kis dózisaiig. A vény nélkül kapható H2-blokkolók példái a cimetidin (Tagamet) és a famotidin (Pepcid, Zantac 360). Tartósabb tünetek esetén a H-2 receptor antagonista gyógyszerek magasabb (vényköteles) dózisai alkalmazhatók, például:
Mindazonáltal a fenntartó (folyamatos) terápiát igénylő tartós tünetek vagy szűkületekkel vagy vérzéssel járó szövődményes GERD esetén protonpumpa-gátlókat (PPI) alkalmaznak. Példák a PPI-kre:
Egyes betegeknek csak egy tablettát kell bevenniük naponta, míg másoknak két tablettára (dupla adag) van szükségük a tünetek enyhítésére. A dupla adag bevehető naponta kétszer egy tablettaként vagy naponta egyszer 2 tabletta formájában.
A PPI-k erősen gátolják a gyomor savkiválasztását. Hatékonyak a gyomorégés enyhítésében és a nyelőcsőgyulladás (oesophagitis) és a savas reflux által kiváltott nyelőcsőfekélyek gyógyításában. A PPI-ket jól tolerálják, kevés mellékhatással. E gyógyszerek abbahagyása után a savas reflux tünetei rendszerint kiújulnak, néha fokozott intenzitással. A tünetek e fokozódása részben a savszekréció visszapattanása (sav-túlválasztás) miatt következik be, amely válasz a PPI savszekréciójának gátlásából való felépülésre.
The long-term safety of the PPIs is an important consideration. Although certain stomach tumors (carcinoids) were reported in experiments with older female rats, similar tumors have not been observed in people after more than 15 years of PPI use. In some people on long-term PPI therapy, small benign polyps (fundic gland polyps) may develop in the upper half of the stomach. However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. Ezek a következők:
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found
Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
 Kolorektális rák:tünetek, jelek, szűrés, szakaszok
Mi az a vastag- és végbélrák? A vastag- és végbélrák a harmadik leggyakoribb nem bőrrák, amelyet férfiaknál és nőknél is diagnosztizálnak az Egyesült Államokban, és a rákos halálozások második vezet
Kolorektális rák:tünetek, jelek, szűrés, szakaszok
Mi az a vastag- és végbélrák? A vastag- és végbélrák a harmadik leggyakoribb nem bőrrák, amelyet férfiaknál és nőknél is diagnosztizálnak az Egyesült Államokban, és a rákos halálozások második vezet
 Hasnyálmirigyrák
Milyen tényeket kell tudnom a hasnyálmirigyrákról? Az iStock képe egy hasnyálmirigyrákos férfiról A hasüregben található hasnyálmirigynek endokrin (hormonális) és exokrin (emésztési) funkciójú sejtj
Hasnyálmirigyrák
Milyen tényeket kell tudnom a hasnyálmirigyrákról? Az iStock képe egy hasnyálmirigyrákos férfiról A hasüregben található hasnyálmirigynek endokrin (hormonális) és exokrin (emésztési) funkciójú sejtj
 Amit eszik, megváltoztathatja az antibiotikumok bélrendszeri hatását
A Rhode Island -i Brown Egyetem kutatóinak új tanulmánya megállapította, hogy az étrend befolyásolhatja, hogy az antibiotikumokkal végzett kezelés hogyan befolyásolja a bél mikrobiómáját. A tudósok me
Amit eszik, megváltoztathatja az antibiotikumok bélrendszeri hatását
A Rhode Island -i Brown Egyetem kutatóinak új tanulmánya megállapította, hogy az étrend befolyásolhatja, hogy az antibiotikumokkal végzett kezelés hogyan befolyásolja a bél mikrobiómáját. A tudósok me