 El 10 % de los pacientes con ERGE desarrollan esófago de Barrett, un factor de riesgo de cáncer de esófago.
El 10 % de los pacientes con ERGE desarrollan esófago de Barrett, un factor de riesgo de cáncer de esófago.

El esófago de Barrett no tiene síntomas únicos. Los pacientes con enfermedad de Barrett tienen los síntomas de ERGE o reflujo ácido que incluyen los siguientes:
El esófago de Barrett es una complicación de la enfermedad por reflujo gastroesofágico crónico (ERGE), principalmente en hombres blancos. La ERGE es una enfermedad en la que hay reflujo de líquido ácido desde el estómago hacia el esófago (el conducto para tragar). La ERGE suele causar acidez estomacal.
Hay dos requisitos para el diagnóstico del esófago de Barrett. Los requisitos requieren una endoscopia del esófago. Durante la endoscopia, se inserta un tubo largo y flexible con una luz y una cámara en la punta (un endoscopio) a través de la boca y hacia el esófago para ver y hacer una biopsia (muestra de tejido) del revestimiento del esófago. Los dos requisitos son:
El esófago de Barrett está codificado oficialmente por la Biblioteca del Congreso para búsquedas electrónicas de la literatura como esófago de Barrett, pero el esófago de Barrett (con el apóstrofe "s") es el nombre que se usa universalmente. La condición lleva el nombre de un cirujano, Norman Barrett, quien describió la condición. Sin embargo, resulta que su interpretación de los hallazgos no era correcta. En 1953, los doctores Allison y Johnstone describieron esta condición tal como la entendemos ahora, es decir, que estaba ocurriendo metaplasia. (Metaplasia, que se analiza a continuación, es el término que se usa cuando un tejido adulto reemplaza a otro). Sin embargo, la condición ha sido inmortalizada con el nombre de Barrett.
Inicialmente, se pensó que el esófago de Barrett consistía en tejido estomacal (gástrico) que reemplazaba el tejido escamoso habitual que recubre el esófago. Sin embargo, a mediados de los años 70, el Dr. Paull y sus colegas publicaron un artículo en el que describían la mucosa (revestimiento interno) del esófago de Barrett con más detalle que antes. Señalaron que el esófago de Barrett consistía en una metaplasia en la que las células normales que recubren el esófago fueron reemplazadas por una mezcla de células gástricas e intestinales. Las células de revestimiento de tipo intestinal también se denominan células columnares especializadas que incluyen células caliciformes. Durante varios años, algunos científicos pensaron que había dos tipos de Barrett; uno en el que el revestimiento normal se reemplazó con células de tipo estomacal (gástrico) solamente, y el segundo en el que estaban presentes células intestinales. Sin embargo, la creencia actual es que solo la presencia de células caliciformes de tipo intestinal establece el diagnóstico de esófago de Barrett, independientemente de qué otros tipos de células estén presentes.
La razón del gran interés en el esófago de Barrett es que está asociado con un mayor riesgo de cáncer de esófago. El tipo de cáncer que ocurre en pacientes con Barrett es el adenocarcinoma, que surge del tejido intestinal metaplásico. El cáncer habitual del esófago que no está asociado con el síndrome de Barrett es el carcinoma escamoso, que surge del revestimiento de células escamosas que normalmente está presente en el esófago. La conexión entre el adenocarcinoma de esófago y el esófago de Barrett ahora está clara, y la frecuencia del adenocarcinoma de esófago está aumentando en la mayoría de los países del hemisferio occidental.
Sin embargo, la buena noticia es que el cáncer ocurre en relativamente pocos pacientes con esófago de Barrett. Aún así, el principal desafío en esta condición es estar atento a los primeros signos de advertencia de cáncer mediante la toma de biopsias a intervalos regulares durante la endoscopia. Esta práctica se denomina vigilancia y es similar, en principio, a la vigilancia en mujeres por cáncer de cuello uterino, en la que se toman pruebas de Papanicolaou a intervalos regulares.
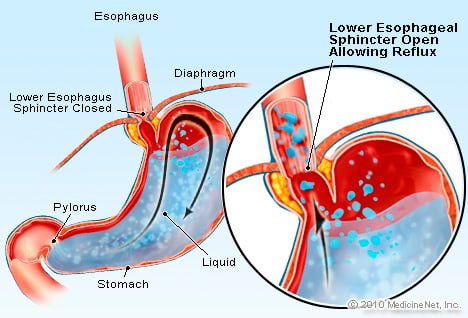
 GERD es una condición en la cual un exceso de líquido que contiene ácido refluye (fluye) hacia el esófago, en parte porque el esfínter esofágico inferior es débil.
GERD es una condición en la cual un exceso de líquido que contiene ácido refluye (fluye) hacia el esófago, en parte porque el esfínter esofágico inferior es débil. GERD causa el esófago de Barrett. El esófago es un tubo muscular que se encuentra en el tórax y sirve para trasladar los alimentos desde la boca hasta el estómago. El esfínter esofágico inferior (EEI) es una válvula que se encuentra en la unión del estómago con el esófago. Su función es evitar que el ácido y otros contenidos del estómago regresen al esófago. La ERGE es una afección en la que un exceso de líquido que contiene ácido refluye (fluye) hacia el esófago, en parte porque el esfínter esofágico inferior está débil. La debilidad del EEI puede estar relacionada, en parte, con el hecho de que prácticamente todos los pacientes con ERGE tienen hernia de hiato. En pacientes con hernia hiatal, los pocos centímetros superiores del estómago se deslizan hacia adelante y hacia atrás entre el abdomen y el tórax a través del diafragma. Este deslizamiento puede interferir con el funcionamiento del esfínter como barrera para el reflujo del estómago al esófago.
Anteriormente, se usaba el término hernia en lugar de ERGE para explicar a los pacientes la base de sus síntomas (por lo general, acidez estomacal) porque prácticamente todos los pacientes con ERGE tienen hernias de hiato. GERD, sin embargo, es el término más exacto. Si bien las hernias de hiato son extremadamente comunes en la población, solo una pequeña cantidad de personas con hernia de hiato desarrollan ERGE. En otras palabras, la presencia de una hernia de hiato no significa que la persona desarrollará ERGE. Sin embargo, por otro lado, si una persona tiene ERGE, la hernia de hiato casi siempre está presente.
Por lo tanto, el esófago de Barrett es causado por reflujo ácido crónico (de muchos años de duración) y generalmente severo. En algunos pacientes con ERGE, el esófago reacciona a la lesión repetida del líquido ácido cambiando el tipo de células que lo recubren de escamosas (células normales) a columnares (células de tipo intestinal). Se cree que esta transformación, llamada metaplasia, es una respuesta protectora porque el epitelio cilíndrico especializado (epitelio significa revestimiento) en el esófago de Barrett es más resistente a las lesiones por ácido que el epitelio escamoso.
El fluido en el estómago contiene ácido que es producido por el estómago. Además, sin embargo, el líquido puede contener ácidos biliares (de la bilis producida por el hígado) y enzimas (producidas por el páncreas) que han regresado del duodeno al estómago. (El duodeno es la primera parte del intestino delgado justo después del estómago). El ácido que refluye desde el estómago hacia el esófago es perjudicial para el esófago. Sin embargo, existe alguna evidencia de que las enzimas biliares y pancreáticas combinadas con el ácido pueden ser más dañinas que el ácido solo.
Un porcentaje significativo de personas con síntomas crónicos de ERGE desarrollan esófago de Barrett, y es más común en poblaciones de hombres caucásicos. Sin embargo, no todas las personas con ERGE tienen síntomas de ERGE. Por lo tanto, algunas personas con Barrett no saben que tienen Barrett porque tienen ERGE sin ningún síntoma o tienen síntomas muy leves e infrecuentes.
No está claro por qué el esófago de Barrett es tan abrumadoramente más común en los hombres blancos que en cualquier otro grupo. Por ejemplo, aunque las mujeres y los afroamericanos no parecen estar protegidos contra la ERGE, sí lo están (especialmente los afroamericanos) contra el esófago de Barrett y el cáncer de Barrett (adenocarcinoma). Existe evidencia de que en el hemisferio occidental, el cáncer de esófago y el cáncer de la unión gastroesofágica (llamado cáncer de cardias) están aumentando en frecuencia, quizás más que cualquier otro cáncer del tracto gastrointestinal. (Sin embargo, el cáncer de colon sigue siendo mucho más común que el cáncer de esófago).
El esófago de Barrett puede presentarse en algunas familias y estar determinado genéticamente. Se están realizando estudios para determinar si se pueden encontrar genes o marcadores en estas familias que puedan predecir el desarrollo del esófago de Barrett en la población general. En estas familias con Barrett así como con Barrett en la población general, GERD es el denominador común. Sin embargo, la pregunta es por qué la enfermedad de Barrett ocurre con más frecuencia en estas familias que en otras con ERGE de gravedad comparable, pero sin asociación familiar.
Para repetir, el primer criterio para el diagnóstico del esófago de Barrett es el hallazgo en la endoscopia de un revestimiento rosado en el esófago donde normalmente no se ve. Este revestimiento anormal puede aparecer circunferencialmente como una banda, como una lengua o como islas. El segundo criterio es que las biopsias del revestimiento rosado revelen la mucosa intestinalizada característica (el revestimiento que normalmente se ve en los intestinos) con las típicas células caliciformes. Las biopsias esofágicas se obtienen durante una endoscopia. Una endoscopia gastrointestinal superior es un procedimiento en el que el médico inserta un tubo largo y flexible (endoscopio) a través de la boca y hacia el esófago para visualizar directamente el revestimiento del esófago. Durante el mismo examen endoscópico, también se pueden visualizar el estómago y el duodeno. Se pueden obtener múltiples muestras pequeñas (biopsias) del tejido epitelial de revestimiento a través del endoscopio.
Como se mencionó anteriormente, el proceso de reemplazo de un tipo de revestimiento de tejido por otro se llama metaplasia. En el estómago y los intestinos, la metaplasia es una respuesta común a ciertos tipos de lesiones. Como dijo Henry Appelman, un patólogo:"Cuando el intestino está bajo estrés, quiere ser otra cosa". Otros ejemplos de metaplasia en los que un revestimiento reemplaza a otro son:(1) en el estómago, donde la inflamación crónica (gastritis) puede provocar que un revestimiento de tipo intestinal reemplace partes del revestimiento normal del estómago; y (2) en el duodeno (justo más allá del estómago en el intestino) donde se producen las úlceras pépticas y el revestimiento intestinal que rodea la úlcera se transforma en un revestimiento similar al del estómago.
Creemos que el proceso de metaplasia es una respuesta protectora o adaptativa a la lesión del revestimiento. Sin embargo, la desventaja de la metaplasia es que en el esófago de Barrett conlleva un aumento pequeño pero definitivo en el riesgo de volverse canceroso. No todas las metaplasias tienen un mayor riesgo de cáncer. Por ejemplo, de las dos metaplasias mencionadas en el párrafo anterior, la metaplasia intestinal en el estómago puede provocar cáncer, pero la metaplasia intestinal en el duodeno no.
El proceso de desarrollo de Barrett comienza en la unión de los revestimientos del estómago y el esófago. El esófago normalmente está revestido por un epitelio escamoso o una capa de revestimiento. Este epitelio escamoso tiene un aspecto blanco nacarado, mientras que el revestimiento del estómago y los intestinos tiene un color más rosa salmón porque es un epitelio cilíndrico en lugar de un epitelio escamoso. El epitelio escamoso está formado por células escamosas planas, que son similares a las células de la piel. El revestimiento del estómago o gástrico consta de células columnares más altas, como se ve bajo el microscopio. La unión del epitelio escamoso del esófago y el epitelio cilíndrico gástrico se produce en la unión del esófago y el estómago donde, como recordará, se encuentra el esfínter esofágico inferior. El borde común (interfaz) de estos dos revestimientos a menudo se denomina línea Z, porque cuando se examina durante una endoscopia, tiene una apariencia en zigzag.
Con la lesión progresiva del esófago, se produce metaplasia y el tejido metaplásico sube por el esófago una distancia que varía de una persona a otra, normalmente de aproximadamente 0,5 a 2,5 pulgadas (alrededor de 1 a 6 centímetros). Se desconoce el tipo de célula que da lugar al tejido metaplásico.
El esófago de Barrett a menudo se clasifica en esófago de Barrett de segmento corto o largo, según la longitud del esófago afectado. El segmento corto de Barrett generalmente se refiere a la participación de 3 centímetros o menos, mientras que el segmento largo significa la participación de más de 3 centímetros del esófago. Curiosamente, una vez que se diagnostica el esófago de Barrett en un paciente, el revestimiento metaplásico no parece progresar más hacia el esófago si el paciente está siendo tratado por ERGE. Por lo tanto, con el tiempo, la duración de la relación con Barrett generalmente sigue siendo la misma.
Si se toman biopsias de pacientes con ERGE que tienen una línea Z de apariencia normal (sin evidencia visible de esófago de Barrett), hasta el 30 % mostrará la misma metaplasia de tipo intestinal con células caliciformes que las que se observan en el esófago de Barrett. Sin embargo, no realizamos biopsias de forma rutinaria de las líneas Z de apariencia normal para buscar este cambio, ni realizamos vigilancia cuando lo encontramos allí. La razón es que la metaplasia intestinal limitada de la región de la unión gastroesofágica en la ERGE parece ocurrir con una frecuencia similar en mujeres y afroamericanos que en hombres blancos, pero el riesgo de esófago de Barrett manifiesto es mucho menor que en hombres blancos.
Por lo tanto, la presencia de metaplasia en una biopsia de rutina de una línea Z de apariencia normal en la ERGE no debe conducir a ningún cambio en el tratamiento. Es más, el hallazgo de células caliciformes en este contexto no debe etiquetarse, como algunos han sugerido, como un segmento ultracorto de Barrett. La principal razón para no etiquetarlo como Barrett es que el término Barrett implica un mayor riesgo de cáncer y no hay evidencia de que este hallazgo esté asociado con un mayor riesgo de cáncer.
El tipo de cáncer que ocurre con el esófago de Barrett es el adenocarcinoma. El cáncer que surge del revestimiento escamoso del esófago se denomina cáncer escamoso o carcinoma. Entre los caucásicos, la tasa (frecuencia a lo largo del tiempo) del cáncer escamoso está disminuyendo en relación con el adenocarcinoma asociado con el síndrome de Barrett. Sin embargo, otros grupos raciales (por ejemplo, los afroamericanos) no han experimentado la misma tasa de disminución del cáncer escamoso en relación con el adenocarcinoma.
Fumar y la ingestión excesiva de alcohol son factores de riesgo definidos para los cánceres escamosos. También son factores de riesgo para el adenocarcinoma observado en el esófago de Barrett. En esta situación, sin embargo, no está claro si el tabaquismo y el alcohol aumentan el riesgo de adenocarcinoma al hacer que la ERGE sea más grave o si el tabaquismo y el alcohol tienen un efecto cancerígeno más directo, como ocurre en el cáncer escamoso. Los cánceres de células escamosas se han vuelto cada vez menos comunes, mientras que los diagnósticos de adenocarcinoma han aumentado. La incidencia de adenocarcinoma en hombres blancos ha aumentado más que en otros grupos étnicos.
En el resto de esta sección, el término cáncer de esófago se referirá al adenocarcinoma que surge del esófago de Barrett.
El cáncer de la unión gastroesofágica también se llama cáncer de cardias porque la región donde el esófago se une con el estómago se llama cardias. Este cáncer, al igual que el adenocarcinoma asociado con Barrett, se encuentra predominantemente en hombres blancos, aparentemente está aumentando en frecuencia al mismo ritmo que el cáncer de esófago y está asociado con ERGE crónica. Por lo tanto, se ha especulado que el cáncer de cardias comienza a partir de segmentos cortos (por ejemplo, 1-2 cm) de Barrett. Sin embargo, cuando se realiza el diagnóstico de cáncer, es posible que el tumor se haya diseminado más allá del segmento corto de Barrett y parezca estar en el cardias. Esta especulación sobre el origen del cáncer del cardias, sin embargo, queda por demostrar.
Se ha observado un aumento en la frecuencia de adenocarcinoma esofágico durante al menos 20 años, principalmente en hombres blancos. Una pista de la razón de esta tendencia puede estar relacionada con una disminución en la frecuencia de H. píloro infección del estómago. En otras palabras, las personas con cáncer de Barrett, incluido el cáncer de cardias, parecen tener tasas más bajas de H. píloro infección que otros de la misma edad y sexo en la misma población.
H. píloro es un tipo de bacteria que es una de las principales causas de las úlceras. Es una infección muy común en todo el mundo y no causa síntomas en la gran mayoría de las personas afectadas. Sin embargo, algunas personas con H. píloro desarrollar úlcera péptica del estómago y el duodeno. Estas úlceras se tratan eliminando las bacterias, lo que a su vez previene la recaída de las úlceras.
Si H. píloro Si no se trata, causa una inflamación progresiva del estómago (gastritis) que se asocia con una reducción de la secreción de ácido y posiblemente con menos reflujo de ácido hacia el esófago. En muchas áreas del mundo, esta infección está disminuyendo en frecuencia, presumiblemente debido a mejores medidas de salud pública. Por lo tanto, es posible que el efecto protector (como la disminución de la producción de ácido) de la H. píloro la infección ha disminuido. En otras palabras, con menos H. píloro gastritis, el estómago produce más ácido y hay más ácido para refluir hacia el esófago. Al mismo tiempo, estamos más predispuestos al reflujo en nuestra vejez. Aunque esto no es un tema resuelto, la frecuencia decreciente de H. píloro la infección puede ser una de las razones del aumento de la frecuencia del adenocarcinoma asociado con la enfermedad de Barrett.
La displasia es un cambio en las células que recubren el esófago en el que las células muestran cambios anormales en su estructura y apariencia. Cuando estos cambios se vuelven lo suficientemente severos (pasando de displasia de bajo grado a alto grado), las células comienzan a parecer malignas (como células cancerosas). Sin embargo, a diferencia del cáncer, estas células permanecen en su lugar y no invaden los tejidos fuera del revestimiento. La displasia ocurre como una serie de cambios celulares a medida que el esófago de Barrett progresa hasta convertirse en cáncer asociado con el síndrome de Barrett. Los pacientes con Barrett son monitoreados con endoscopia y biopsias (vigilancia) para detectar estos cambios celulares (la displasia) o en el peor de los casos, cáncer temprano para que puedan ser tratados. Actualmente, no hay forma de predecir qué pacientes con esófago de Barrett desarrollarán displasia.
También se ha identificado displasia adyacente a tumores del tracto gastrointestinal distintos del adenocarcinoma esofágico. Por ejemplo, la displasia se encuentra en la mitad de los casos de cáncer de estómago y en el cáncer de colon, en los que la displasia es visible como los llamados pólipos adenomatosos. Además, la displasia es el mismo cambio celular de advertencia temprana que los patólogos buscan en las pruebas de Papanicolaou del cuello uterino que predicen el cáncer de cuello uterino.
La displasia se considera premaligna. Esto significa que si se ha demostrado displasia en varias ocasiones, se cree que el paciente desarrollará cáncer si vive lo suficiente. La displasia se clasifica como de alto o bajo grado. Cuando se diagnostica displasia de alto grado, es posible que el cáncer ya esté presente y, de no ser así, el riesgo de desarrollar cáncer antes es mayor que con los grados menores de displasia.
En las biopsias de seguimiento de pacientes con displasia, es posible que la afección no se vuelva a detectar en algunos pacientes, mientras que en otros se encuentran grados bajos de displasia. Esta ausencia o disminución de la displasia puede deberse a factores como las variaciones de muestreo, la eliminación de pequeños focos (grupos de células) de displasia con la biopsia inicial o la reversión biológica real. Se desconocen los motivos exactos.
Usando técnicas moleculares, algunos cambios denominados biomarcadores pueden detectarse en muestras de biopsia antes de que se desarrolle la displasia. Estos cambios son similares a los que se observan en otros tipos de cáncer. Los biomarcadores incluyen cambios en el contenido de ADN de las células, en los genes y cromosomas, y en los factores de crecimiento. Se puede demostrar que varios de estos biomarcadores aparecen antes y durante la aparición de la displasia. El objetivo final es encontrar un marcador mágico que pueda decirnos qué pacientes entre los que no tienen displasia o displasia de bajo grado tienen más probabilidades de desarrollar displasia de alto grado o cáncer. Dichos pacientes pueden ser seguidos mediante vigilancia más de cerca que otros.
En la actualidad, todos los pacientes con esófago de Barrett, desde el punto de vista de la vigilancia, son tratados de la misma manera. La disponibilidad de biomarcadores separaría (estratificaría) a los pacientes de Barrett según su riesgo de cáncer. Dicha estratificación permitiría a los médicos realizar endoscopias de vigilancia y biopsias con mayor frecuencia en la minoría de pacientes que tienen un mayor riesgo de cáncer y con menos frecuencia en aquellos que se prevé que tengan un menor riesgo de cáncer.
Otro uso de los biomarcadores probados sería ayudar a confirmar la interpretación del patólogo de la displasia en las biopsias.
Cuando los pacientes con esófago de Barrett se evalúan como grupo, se ha encontrado que el riesgo de cáncer es tan bajo como uno en 300 pacientes por año. Esto significa que si examináramos a 300 pacientes al año, se encontraría que un paciente tiene cáncer cada año. Lo que realmente necesitamos saber es el riesgo de cáncer si no se encuentra displasia después de uno o dos años de vigilancia. Creemos que este riesgo sería mucho menor que las cifras citadas anteriormente de uno de cada 300 pacientes al año.
A menudo se puede encontrar que los pacientes con displasia de alto grado tienen cáncer. Por lo tanto, el primer orden de manejo cuando se encuentra displasia de alto grado es descartar la presencia de un adenocarcinoma.
La displasia de bajo grado es mucho menos amenazante que la displasia de alto grado, pero no sabemos cuánto menos. De hecho, no tenemos datos precisos para indicar cuál es el riesgo de cáncer en pacientes con Barrett y displasia de bajo grado.
El diagnóstico de displasia debe ser lo más preciso posible ya que este diagnóstico puede impulsar un cambio en el tratamiento o en la intensidad del seguimiento de los pacientes con esófago de Barrett. Se requiere mucha experiencia para poder hacer un diagnóstico preciso de la presencia y grado de displasia. Por lo tanto, es una práctica común y útil pedir a un segundo patólogo (o incluso a un tercero, si es necesario) que revise las biopsias. La idea es ver si hay acuerdo entre los patólogos y/o tener una opinión más experimentada sobre la presencia y grado de displasia.
Si una persona tiene un segmento más largo de Barrett, uno podría suponer que el riesgo de cáncer es mayor que con un segmento más corto de Barrett. Los datos, sin embargo, son controvertidos en este sentido. Por esa razón, la práctica actual es realizar vigilancia con biopsia endoscópica con una frecuencia similar en pacientes con esófago de Barrett de segmento corto y largo.
El esófago de Barrett no tiene síntomas únicos. Los pacientes con Barrett tienen síntomas de ERGE (por ejemplo, acidez estomacal, regurgitación, náuseas, etc.). La tendencia general es que los pacientes de Barrett tengan una ERGE más grave. Sin embargo, no todos los Barrett tienen síntomas marcados de ERGE, y algunos pacientes se detectan accidentalmente con síntomas mínimos o nulos de ERGE.
La acidez estomacal es una sensación de ardor detrás del esternón, generalmente en la mitad inferior, pero puede extenderse hasta la garganta. A veces, se acompaña de ardor o dolor en la boca del estómago, justo debajo de donde termina el esternón. El segundo síntoma más común es la regurgitación (retroceso) de líquido con sabor amargo. Los síntomas de la ERGE a menudo empeoran después de las comidas y cuando se está acostado.
El líquido regurgitado y refluido ocasionalmente puede entrar en los pulmones o en la laringe, lo que da como resultado lo que se denominan síntomas (manifestaciones) extraesofágicos (fuera del esófago) de la ERGE. Estos síntomas incluyen:
Por razones que no se comprenden completamente, algunos pacientes con ERGE tienen acidez estomacal mínima pero experimentan otros síntomas de ERGE, por ejemplo, síntomas extraesofágicos.
La ERGE puede provocar estenosis y ulceración del esófago. Una estenosis o estrechamiento se debe a la cicatrización (fibrosis) del esófago que puede causar dificultad para tragar (disfagia). La disfagia se siente como una adherencia (detención) de alimentos sólidos en el pecho (en el esófago) y líquidos cuando el estrechamiento es severo. Las estenosis se pueden tratar estirándolas con dilatadores durante la endoscopia. Sin tratamiento, las estenosis pueden promover un mayor derrame de alimentos y/o fluidos gástricos hacia los pulmones. Con poca frecuencia, puede ocurrir una hemorragia gastrointestinal (GI) masiva causada por la inflamación del esófago. Tal sangrado da como resultado vómitos de sangre o evacuación de heces negras o marrón. Sin embargo, más comúnmente, un esófago inflamado puede causar un sangrado lento que se detecta cuando se encuentra anemia (un recuento bajo de glóbulos rojos) y/o se analizan las heces para detectar sangre.
Los tratamientos médicos para los síntomas del esófago de Barrett son los mismos que para la ERGE.
La supresión del ácido es la columna vertebral del tratamiento de la ERGE. Para los síntomas leves de reflujo, comúnmente se usan medicamentos de venta libre, que van desde antiácidos hasta dosis bajas de medicamentos llamados antagonistas de los receptores H-2 o bloqueadores H2. Ejemplos de bloqueadores H2 de venta libre son cimetidina (Tagamet) y famotidina (Pepcid, Zantac 360). Para síntomas más persistentes, se pueden usar dosis más altas (prescripción médica) de los fármacos antagonistas del receptor H-2, por ejemplo:
Sin embargo, para los síntomas persistentes que requieren terapia de mantenimiento (continua) o para la ERGE complicada con estenosis o sangrado, se usan inhibidores de la bomba de protones (IBP). Ejemplos de PPI son:
Algunos pacientes necesitan tomar solo una pastilla al día, mientras que otros necesitan dos pastillas (doble dosis) para controlar los síntomas. La dosis doble se puede tomar como una pastilla dos veces al día o 2 pastillas una vez al día.
Los PPI son potentes inhibidores de la secreción de ácido del estómago. Son eficaces para aliviar la acidez estomacal y curar la inflamación esofágica (esofagitis) y las úlceras esofágicas inducidas por el reflujo ácido. Los IBP son bien tolerados y tienen pocos efectos secundarios. Después de suspender estos medicamentos, los síntomas del reflujo ácido suelen reaparecer, a veces con mayor intensidad. Este aumento de los síntomas se produce, en parte, debido a una secreción de ácido de rebote (hipersecreción de ácido), que es una respuesta provocada por la recuperación de la inhibición de la secreción de ácido por parte del PPI.
La seguridad a largo plazo de los IBP es una consideración importante. Although certain stomach tumors (carcinoids) were reported in experiments with older female rats, similar tumors have not been observed in people after more than 15 years of PPI use. In some people on long-term PPI therapy, small benign polyps (fundic gland polyps) may develop in the upper half of the stomach. However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. Estos incluyen:
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found
Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
 ¿Cómo se realiza una manometría esofágica?
¿Cómo se realiza una manometría esofágica?
 Receta de carrilleras de res cocidas a fuego lento
Receta de carrilleras de res cocidas a fuego lento
 8 personas infectadas en un raro brote de virus de rata en EE. UU.
8 personas infectadas en un raro brote de virus de rata en EE. UU.
 ¿Cómo se realiza una biopsia hepática transyugular?
¿Cómo se realiza una biopsia hepática transyugular?
 Personas que contraen infecciones de caca de cachorros en tiendas de mascotas:CDC
Personas que contraen infecciones de caca de cachorros en tiendas de mascotas:CDC
 Un tipo de bacteria intestinal puede aumentar el riesgo de cáncer de intestino.
Un tipo de bacteria intestinal puede aumentar el riesgo de cáncer de intestino.
 Síntomas, causas y tratamiento del tenesmo rectal
Tenesmo es un término médico que se usa para describir la sensación de que necesita hacer caca aunque sus intestinos estén vacíos. El tenesmo no es una enfermedad en sí misma. Más bien, es un síntoma
Síntomas, causas y tratamiento del tenesmo rectal
Tenesmo es un término médico que se usa para describir la sensación de que necesita hacer caca aunque sus intestinos estén vacíos. El tenesmo no es una enfermedad en sí misma. Más bien, es un síntoma
 ¿Por qué me duele el estómago después de cada comida?
¿Qué es el dolor de estómago? Su estómago puede doler después de cada comida debido al síndrome del intestino irritable (IBS), dispepsia funcional (FD), aguda pancreatitis u otras condiciones. E
¿Por qué me duele el estómago después de cada comida?
¿Qué es el dolor de estómago? Su estómago puede doler después de cada comida debido al síndrome del intestino irritable (IBS), dispepsia funcional (FD), aguda pancreatitis u otras condiciones. E
 Tumores neuroendocrinos pancreáticos (tumores de células de los islotes)
Información sobre los tumores neuroendocrinos pancreáticos (TNE o tumores de células de los islotes)* Los tumores neuroendocrinos pancreáticos se forman en las células productoras de hormonas (célul
Tumores neuroendocrinos pancreáticos (tumores de células de los islotes)
Información sobre los tumores neuroendocrinos pancreáticos (TNE o tumores de células de los islotes)* Los tumores neuroendocrinos pancreáticos se forman en las células productoras de hormonas (célul