 10% GERD:n potilaista kehittää Barrettin ruokatorvion, riskitekijä ruokatorven syöpä.
10% GERD:n potilaista kehittää Barrettin ruokatorvion, riskitekijä ruokatorven syöpä.

Barrettin ruokatorvella ei ole ainutlaatuisia oireita. Barrettin tautia sairastavilla potilailla on GERD-oireita tai happamat refluksitaudit, joihin kuuluvat seuraavat:
Barrettin ruokatorvi on kroonisen gastroesofageaalisen refluksitaudin (GERD) komplikaatio, pääasiassa valkoisilla miehillä. GERD on sairaus, jossa hapan neste palautuu mahasta ruokatorveen (nielemisputki). GERD aiheuttaa yleisimmin närästystä.
Barrettin ruokatorven diagnoosille on asetettu kaksi vaatimusta. Vaatimukset edellyttävät ruokatorven endoskopiaa. Endoskopian aikana pitkä joustava putki, jonka kärjessä on valo ja kamera (endoskooppi), työnnetään suun kautta alas ruokatorveen, jotta ruokatorven limakalvosta voidaan tarkastella ja ottaa biopsia (näytekudosta). Nämä kaksi vaatimusta ovat:
Kongressin kirjasto on koodannut Barrettin ruokatorven virallisesti Barrettin ruokatorven sähköisiä hakuja varten, mutta Barrettin ruokatorvi (jossa heittomerkki "s") on yleisesti käytetty nimi. Ehto on nimetty kirurgin, Norman Barrettin jälkeen, joka kuvaili tilannetta. On kuitenkin osoittautunut, että hänen tulkinnan tuloksista ei ollut oikea. Vuonna 1953 Doctors' Allison ja Johnstone itse asiassa kuvailivat tätä tilaa sellaisena kuin me sen nyt ymmärrämme, nimittäin metaplasiaa esiintyvän. (Metaplasiaa, josta keskustellaan alla, käytetään termiä, kun yksi aikuisen kudos korvaa toisen.) Siitä huolimatta sairaus on ikuistettu Barrettin nimeen.
Aluksi ajateltiin, että Barrettin ruokatorvi koostui mahakudoksesta, joka korvasi tavanomaisen ruokatorvea peittävän levyepiteelikudoksen. Kuitenkin 70-luvun puolivälissä tohtori Paull ja kollegat julkaisivat paperin, jossa he kuvasivat Barrettin ruokatorven limakalvoa (sisävuorausta) yksityiskohtaisemmin kuin aiemmin. He huomauttivat, että Barrettin ruokatorvi koostui metaplasiasta, jossa ruokatorven normaalit solut korvattiin mahalaukun ja suoliston limakalvosolujen seoksella. Suolistotyyppisiä vuoraussoluja kutsutaan myös erikoistuneiksi pylvässoluiksi, jotka sisältävät pikarisoluja. Jotkut tutkijat ajattelivat useiden vuosien ajan, että Barrettin tyyppiä oli kahdenlaisia; yksi, jossa normaali limakalvo korvattiin vain mahalaukun (maha)tyyppisillä soluilla, ja toisessa, jossa oli suolistosoluja. Nykyinen uskomus on kuitenkin, että vain suolistotyyppisten pikarisolujen läsnäolo vahvistaa Barrettin ruokatorven diagnoosin riippumatta siitä, mitä muita solutyyppejä on olemassa.
Syynä suureen kiinnostukseen Barrettin ruokatorvea kohtaan on se, että se liittyy lisääntyneeseen ruokatorven syövän riskiin. Barrettia sairastavilla potilailla esiintyvä syöpätyyppi on adenokarsinooma, joka syntyy metaplastisesta suoliston kudoksesta. Tavallinen ruokatorven syöpä, joka ei liity Barrettin tautiin, on levyepiteelisyöpä, joka syntyy ruokatorvessa normaalisti esiintyvästä levyepiteelikalvosta. Ruokatorven adenokarsinooman ja Barrettin ruokatorven välinen yhteys on nyt selvä, ja ruokatorven adenokarsinooman esiintyvyys lisääntyy useimmissa läntisen pallonpuoliskon maissa.
Hyvä uutinen on kuitenkin, että syöpä esiintyy suhteellisen harvoilla potilailla, joilla on Barrettin ruokatorvi. Silti suurin haaste tässä tilassa on tarkkailla syövän varhaisia varoitusmerkkejä ottamalla biopsiat säännöllisin väliajoin endoskopian aikana. Tätä käytäntöä kutsutaan tarkkailuksi, ja se on periaatteessa samanlainen kuin naisten kohdunkaulan syövän seuranta, jossa PAP-näytteet otetaan säännöllisin väliajoin.
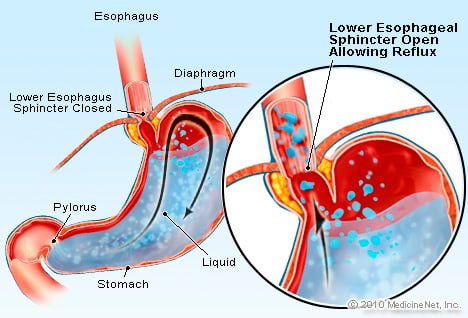
 GERD on tila, jossa liiallinen happo sisältävä neste refluksoi (virtaa) takaisin ruokatorveen, osittain ruokatorven alasulkijalihas on heikko.
GERD on tila, jossa liiallinen happo sisältävä neste refluksoi (virtaa) takaisin ruokatorveen, osittain ruokatorven alasulkijalihas on heikko. GERD aiheuttaa Barrettin ruokatorven. Ruokatorvi on lihaksikas putki, joka sijaitsee rinnassa ja jonka tehtävänä on siirtää ruokaa suusta mahalaukkuun. Alempi ruokatorven sulkijalihas (LES) on venttiili, joka sijaitsee mahalaukun ja ruokatorven risteyksessä. Sen tehtävänä on estää hapon ja muun mahalaukun sisällön joutuminen takaisin ruokatorveen. GERD on tila, jossa liiallinen happoa sisältävä neste palautuu takaisin ruokatorveen, osittain siksi, että ruokatorven alasulkijalihas on heikko. LES:n heikkous voi liittyä osittain siihen tosiasiaan, että käytännössä kaikilla GERD-potilailla on hiataltyrä. Potilailla, joilla on hiataltyrä, vatsan ylemmät muutama senttimetrit liukuvat edestakaisin vatsan ja rintakehän välillä pallean läpi. Tämä liukuminen voi häiritä sulkijalihaksen toimintaa esteenä palautumiselle mahasta ruokatorveen.
Aikaisemmin termiä tyrä käytettiin GERD:n sijaan selitettäessä potilaille heidän oireidensa (yleensä närästyksen) perusteita, koska käytännössä kaikilla GERD-potilailla on hiatal-tyrä. GERD on kuitenkin tarkempi termi. Vaikka hiataltyrät ovat erittäin yleisiä väestössä, vain pienelle osalle hiataltyrästä kehittyy GERD. Toisin sanoen hiataltyrä ei tarkoita, että henkilölle kehittyy GERD. Toisaalta, jos henkilöllä on GERD, hiataltyrä on lähes aina läsnä.
Näin ollen Barrettin ruokatorvi johtuu kroonisesta (monia vuosia kestävästä) ja tavallisesti vaikeasta happamasta refluksista. Joillakin potilailla, joilla on GERD, ruokatorvi reagoi toistuvaan happaman nesteen aiheuttamaan vaurioon muuttamalla sitä peittävien solujen tyyppiä levyepiteelimäisistä (normaalit solut) pylväsmäisiksi (suolityyppiset solut). Tämän metaplasiaksi kutsutun transformaation uskotaan olevan suojareaktio, koska Barrettin ruokatorven erikoistunut pylväsepiteeli (epiteeli tarkoittaa limakalvoa) kestää hapon aiheuttamia vaurioita paremmin kuin levyepiteeli.
Mahalaukun neste sisältää mahalaukun tuottamaa happoa. Lisäksi neste voi kuitenkin sisältää sappihappoja (maksan tuottamasta sapesta) ja entsyymejä (haiman tuottamia), jotka ovat palautuneet pohjukaissuolesta mahalaukkuun. (Pohjukaissuoli on ohutsuolen ensimmäinen osa heti mahan takana.) Happo, joka palautuu mahasta ruokatorveen, on haitallista ruokatorvelle. On kuitenkin todisteita siitä, että sappi- ja haimaentsyymit yhdessä hapon kanssa voivat olla haitallisempia kuin pelkkä happo.
Merkittävä osa henkilöistä, joilla on kroonisia GERD-oireita, kehittää Barrettin ruokatorven, ja se on yleisin valkoihoisissa miespopulaatioissa. Kaikilla, joilla on GERD, ei kuitenkaan ole GERD-oireita. Siksi jotkut Barrettia sairastavat eivät tiedä sairastavansa Barrettia, koska heillä on GERD ilman oireita tai heillä on erittäin lieviä ja harvinaisia oireita.
On epäselvää, miksi Barrettin ruokatorvi on niin ylivoimaisesti yleisempi valkoisilla miehillä kuin missään muussa ryhmässä. Esimerkiksi vaikka naiset ja afroamerikkalaiset eivät näytä olevan suojassa GERD:n kehittymiseltä, he ovat suurelta osin suojassa (etenkin afroamerikkalaiset) Barrettin ruokatorven ja Barrettin syövän (adenokarsinooman) kehittymiseltä. On näyttöä siitä, että läntisellä pallonpuoliskolla ruokatorven syöpä ja gastroesofageaalisen liitoskohdan syöpä (kutsutaan sydänsyöpään) yleistyvät, ehkä enemmän kuin mikään muu maha-suolikanavan syöpä. (Kuitenkin paksusuolensyöpä on edelleen paljon yleisempi kuin ruokatorven syöpä.)
Barrettin ruokatorvion voi toimia joissakin perheissä ja se on geneettisesti määritetty. Parhaillaan tutkitaan, löytyykö näistä perheistä geenejä tai markkereita, jotka ennustaisivat Barrettin ruokatorven kehittymisen väestössä. Näissä perheissä, joissa on Barrettia, sekä Barrettia sairastavilla yleisväestössä GERD on yhteinen nimittäjä. Kysymys kuuluu kuitenkin, miksi Barrettia esiintyy yleisemmin näissä perheissä kuin muissa, joilla on verrattain vaikea GERD, mutta joilla ei ole perheyhteyttä.
Toistaakseni Barrettin ruokatorven diagnoosin ensimmäinen kriteeri on endoskopiassa todettavissa oleva vaaleanpunainen limakalvo ruokatorvessa, jossa sitä ei normaalisti nähdä. Tämä epänormaali limakalvo voi näyttää kehämäiseltä nauhalta, kielen kaltaiselta tai saarekkeelta. Toinen kriteeri on, että vaaleanpunaisesta limakalvosta otetut biopsiat paljastavat tyypillisen suoliston limakalvon (suolessa normaalisti näkyvän limakalvon), jossa on tyypillisiä pikarisoluja. Ruokatorven biopsiat otetaan endoskopian aikana. Ylemmän maha-suolikanavan endoskopia on toimenpide, jossa lääkäri työntää pitkän joustavan putken (endoskoopin) suun läpi ja alas ruokatorveen visualisoidakseen suoraan ruokatorven limakalvon. Saman endoskooppisen tutkimuksen aikana mahalaukku ja pohjukaissuoli voidaan visualisoida. Endoskoopin kautta voidaan ottaa useita pieniä näytteitä (biopsia) limakalvon epiteelikudoksesta.
Kuten aiemmin mainittiin, prosessia, jossa yhden tyyppinen kudosvuoraus korvataan toisella, kutsutaan metaplasiaksi. Mahalaukussa ja suolistossa Metaplasia on yhteinen vastaus tiettyihin vahinkoihin. Patologi Henry Appelman totesi:"Kun suolisto on stressissä, se haluaa olla jotain muuta." Muita esimerkkejä metaplasiasta, jossa yksi limakalvo korvaa toisen, ovat:(1) mahalaukussa, jossa krooninen tulehdus (gastriitti) voi johtaa suolistotyyppiseen limakalvoon, joka korvaa osia normaalista mahalaukun limakalvosta; ja (2) pohjukaissuolessa (juuri mahalaukun takana suolistossa), jossa esiintyy peptisiä haavaumia ja haavaa ympäröivä suolen limakalvo muuttuu mahatyyppiseksi limakalvoksi.
Uskomme, että metaplasiaprosessi on suojaava tai mukautuva vaste limakalvon vaurioille. Metaplasian haittapuoli on kuitenkin se, että Barrettin ruokatorvessa se lisää pientä mutta selvää lisäystä syöpäriskissä. Kaikilla metaplasioilla ei ole lisääntynyttä syöpäriskiä. Esimerkiksi kahdesta edellisessä kappaleessa mainituista metaplasiasta mahalaukun suoliston metaplasia voi johtaa syöpään, mutta pohjukaissuolen suoliston metaplasia ei.
Barrettin kehittymisprosessi alkaa mahalaukun ja ruokatorven limakalvojen risteyksestä. Ruokatorvi on tavallisesti vuorattu levyepiteelillä tai vuorauksella. Tällä levyepiteelillä on helmenvalkoinen ulkonäkö, kun taas mahalaukun ja suoliston limakalvolla on enemmän lohenpunaista väriä, koska se on pylväsepiteeli eikä levyepiteeli. Levyepiteeli koostuu litteistä levyepiteelisoluista, jotka ovat samanlaisia kuin ihosolut. Vatsa- tai mahalaukun limakalvo koostuu korkeammista pylväsmäisistä soluista mikroskoopilla katsottuna. Ruokatorven levyepiteelin ja mahalaukun pylväsepiteelin risteys tapahtuu ruokatorven ja mahan risteyksessä, jossa, kuten muistatte, ruokatorven alasulkijalihas sijaitsee. Näiden kahden vuorauksen yhteistä reunaa (rajapintaa) kutsutaan usein Z-viivaksi, koska se on endoskopian aikana tutkittuna siksak-muotoinen.
Ruokatorven etenevän vaurion yhteydessä esiintyy metaplasiaa ja metaplastinen kudos liikkuu ruokatorvea ylöspäin matkan, joka vaihtelee henkilöstä toiseen, yleensä noin 0,5-2,5 tuumaa (noin 1-6 senttimetriä). Solutyyppiä, joka synnyttää metaplastisen kudoksen, ei tunneta.
Barrettin ruokatorvi luokitellaan usein lyhyen tai pitkän segmentin Barrettin ruokatorven pituuden perusteella. Lyhyt segmentti Barrettin viittaa yleensä 3 senttimetrin tai pienempään osaan, kun taas pitkä segmentti tarkoittaa yli 3 senttimetriä ruokatorvea. Mielenkiintoista on, että kun potilaalla on diagnosoitu Barrettin ruokatorvi, metaplastinen limakalvo ei näytä etenevän edelleen ruokatorveen, jos potilasta hoidetaan GERD:n vuoksi. Näin ollen ajan myötä Barrettin kanssa tekemisen kesto pysyy yleensä samana.
Jos biopsiat otetaan GERD-potilailta, joilla on normaali ilmeinen Z-linja (ei näkyviä todisteita Barrettin ruokatorvesta), jopa 30 %:lla on samanlainen suolistotyyppinen metaplasia pikarisoluineen kuin Barrettin ruokatorvessa. Emme kuitenkaan rutiininomaisesti ota biopsiaa normaaleista Z-linjoista etsiäksemme tätä muutosta, emmekä tee valvontaa, kun löydämme sen sieltä. Syynä on, että GERD:n mahalaukun ruokatorven liitosalueen rajoitettua suoliston metaplasiaa näyttää esiintyvän yhtä usein naisilla ja afroamerikkalaisilla kuin valkoisilla miehillä, mutta Barrettin ruokatorven ilmeisen riski on paljon pienempi kuin valkoisilla miehillä.
Siksi metaplasian esiintyminen normaalin Z-linjan rutiinibiopsiassa GERD:ssä ei saisi johtaa muutokseen hallinnassa. Lisäksi pikarisolujen löytöä tässä yhteydessä ei pitäisi leimata, kuten jotkut ovat ehdottaneet, ultralyhyiksi Barrettisegmenteiksi. Suurin syy siihen, miksi sitä ei merkitä Barrettiksi, on se, että termi Barretti viittaa lisääntyneeseen syöpäriskiin, eikä ole näyttöä siitä, että tämä löydös liittyisi lisääntyneeseen syöpäriskiin.
Barrettin ruokatorvessa esiintyvä syöpätyyppi on adenokarsinooma. Ruokatorven limakalvon limakalvosta syntyvää syöpää kutsutaan levyepiteelisyöpäksi tai karsinoomaksi. Valkoihoisten keskuudessa levyepiteelisyövän esiintyvyys (yleisyys ajan myötä) on laskenut verrattuna Barrettiin liittyvään adenokarsinoomaan. Muut rodulliset ryhmät (esimerkiksi afroamerikkalaiset) eivät kuitenkaan ole kokeneet levyepiteelisyövän samanlaista vähenemistä adenokarsinoomaan verrattuna.
Tupakointi ja liiallinen alkoholin nauttiminen ovat selviä riskitekijöitä okalevysyöpien kehittymiselle. Ne ovat myös Barrettin ruokatorven adenokarsinoomin riskitekijöitä. Tässä tilanteessa ei kuitenkaan ole selvää, lisäävätkö tupakointi ja alkoholi adenokarsinooman riskiä tehden GERD:stä vakavampaa vai onko tupakoinnilla ja alkoholilla suorempi syöpää aiheuttava vaikutus, kuten levyepiteelisyöpässä. Levyepiteelisyövät ovat tulleet yhä harvinaisemmiksi, kun taas adenokarsinoomadiagnoosit ovat lisääntyneet. Adenokarsinooman ilmaantuvuus valkoisilla miehillä on lisääntynyt jyrkemmin kuin muissa etnisissä ryhmissä.
Koko tämän osan loppuosassa termi ruokatorven syöpä viittaa Barrettin ruokatorvesta johtuvaan adenokarsinoomaan.
Gastroesofageaalisen liitoksen syöpää kutsutaan myös sydänsyöväksi, koska aluetta, jossa ruokatorvi kohtaa mahalaukun, kutsutaan kardiaksi. Tämä syöpä, kuten Barrettiin liittyvä adenokarsinooma, esiintyy pääasiassa valkoisilla miehillä, ilmeisesti lisääntyy yhtä nopeasti kuin ruokatorven syöpä, ja se liittyy krooniseen GERD:hen. Siksi on arveltu, että sydänsyöpä alkaa Barrettin lyhyistä osista (esimerkiksi 1-2 cm). Syövän diagnoosiin mennessä kasvain on kuitenkin voinut levitä Barrettin lyhyen osan ulkopuolelle ja näyttää olevan sydämessä. Tämä sydänsyövän alkuperää koskeva spekulaatio on kuitenkin vielä todistettava.
Ruokatorven adenokarsinooman esiintymistiheyden lisääntymistä on havaittu vähintään 20 vuoden ajan, pääasiassa valkoisilla miehillä. Yksi vihje tämän trendin syystä voi liittyä H:n esiintymistiheyden vähenemiseen. pylori vatsan tulehdus. Toisin sanoen ihmisillä, joilla on Barrettin syöpä, mukaan lukien sydänsyöpä, näyttää olevan pienempi H. pylori infektio kuin muut samasta iästä ja sukupuolesta samassa väestössä.
H. pylori on eräänlainen bakteeri, joka on suurin haavaumien aiheuttaja. Se on erittäin yleinen infektio maailmanlaajuisesti ja aiheuttaa oireita valtaosassa ihmisistä. Jotkut ihmiset, joilla on H. pylori kehittää mahalaukun ja pohjukaissuolen mahahaava. Näitä haavaumia hoidetaan eliminoimalla bakteerit, mikä puolestaan estää haavaumien uusiutumisen.
Jos H. pylori Hoitamattomana se aiheuttaa progressiivisen mahalaukun tulehduksen (gastriitti), joka liittyy haponerityksen vähenemiseen ja mahdollisesti vähemmän hapon palautumiseen ruokatorveen. Monilla alueilla maailmassa tämän tartunnan esiintymistiheys vähenee, oletettavasti parempien kansanterveystoimien vuoksi. Siksi on mahdollista, että kroonisen H:n suojaava vaikutus (kuten vähentynyt hapon tuotanto) pylori tartunta on vähentynyt. Toisin sanoen vähemmän H. pylori gastriitti, maha tuottaa enemmän happoa ja ruokatorveen palautuu enemmän happoa. Samaan aikaan olemme entistä enemmän palautusjäähdyttimiä vanhempiin vuosina. Vaikka tämä ei ole vakiintunut kysymys, h. pylori infektio voi olla yksi syy Barrettiin liittyvän adenokarsinooman yleistymiseen.
Dysplasia on ruokatorven solujen muutos, jossa solut todella osoittavat epänormaaleja muutoksia rakenteessa ja ulkonäössä. Kun näistä muutoksista tulee tarpeeksi vakavia (siirryttäessä matala-asteisesta dysplasiasta korkea-asteen dysplasiaan), solut alkavat näyttää pahanlaatuisilta (kuten syöpäsoluilta). Toisin kuin syöpä, nämä solut pysyvät kuitenkin paikoillaan eivätkä tunkeudu limakalvon ulkopuolisiin kudoksiin. Dysplasiaa esiintyy sarjana solumuutoksia, kun Barrettin ruokatorvi etenee Barrettiin liittyväksi syöpäksi. Barrettin tautia sairastavia potilaita seurataan endoskopialla ja biopsioilla (seuranta) näiden solumuutosten (dysplasia) tai pahimmassa tapauksessa varhaisen syövän havaitsemiseksi, jotta heidät voidaan hoitaa. Tällä hetkellä ei ole mahdollista ennustaa, kenelle Barrettin ruokatorvea sairastaville potilaille kehittyy dysplasia.
Dysplasiaa on havaittu myös muiden maha-suolikanavan kasvainten kuin ruokatorven adenokarsinooman vieressä. Esimerkiksi dysplasiaa löytyy puolessa mahasyövän tapauksista ja paksusuolensyövistä, joissa dysplasia näkyy ns. adenomatoottisina polyypeina. Lisäksi dysplasia on sama varhaisvaroitussolumuutos, jota patologit etsivät kohdunkaulan PAP-näytteitä, jotka ennustavat kohdunkaulan syöpää.
Dysplasiaa pidetään pahanlaatuisena. Tämä tarkoittaa, että jos dysplasiaa on todettu useaan otteeseen, potilaalle uskotaan kehittyvän syöpä, jos hän elää tarpeeksi kauan. Dysplasia luokitellaan korkea-asteiseksi tai matala-asteiseksi. Kun korkea-asteinen dysplasia diagnosoidaan, syöpä voi olla jo olemassa, ja jos ei, riski saada syöpä aikaisemmin on suurempi kuin heikompien dysplasia-asteiden tapauksessa.
Dysplasiaa sairastavien potilaiden seurantabiopsioissa tilaa ei ehkä havaita uudelleen joillakin potilailla, kun taas toisilla potilailla havaitaan vähäistä dysplasiaa. Tämä dysplasian puuttuminen tai väheneminen voi johtua tekijöistä, kuten näytteenottovaihteluista, pienten dysplasian pesäkkeiden (soluryhmien) poistamisesta alkuperäisen biopsian yhteydessä tai todellisesta biologisesta käänteestä. Tarkkaa syytä ei tunneta.
Molekyylitekniikoita käyttämällä biopsianäytteistä voidaan havaita joitakin muutoksia, joita kutsutaan biomarkereiksi, ennen kuin dysplasia kehittyy. Nämä muutokset ovat samanlaisia kuin ne, joita havaitaan muissa syövissä. Biomarkkereihin kuuluvat muutokset solujen DNA-sisällössä, geeneissä ja kromosomeissa sekä kasvutekijöissä. Useiden näistä biomarkkereista voidaan osoittaa ilmaantuvan ennen dysplasian ilmaantumista ja sen aikana. Lopullisena tavoitteena on löytää maaginen merkkiaine, joka voi kertoa meille, mitkä potilaat, joilla ei ole dysplasiaa tai heikosti dysplasiaa, saavat todennäköisemmin korkealaatuisen dysplasiaa tai syöpää. Tällaisia potilaita voidaan sitten seurata tarkkaavaisemmin kuin toiset.
Tällä hetkellä kaikkia Barrettin ruokatorvea sairastavia potilaita hoidetaan seurannan näkökulmasta samalla tavalla. Biomarkkerien saatavuus erottaisi (kerroittaisi) Barrettin potilaat heidän syöpäriskinsä perusteella. Tällainen kerrostuminen antaisi lääkärille mahdollisuuden tehdä valvontaendoskopiaa ja biopsiaa useammin niille potilaille, joilla on suurempi riski sairastua syöpään, ja harvemmin niille potilaille, joilla ennustetaan olevan pienempi syöpäriski.
Toinen hyväksi havaittujen biomarkkereiden käyttö voisi olla auttaa vahvistamaan patologin tulkintaa dysplasiasta biopsioissa.
Kun Barrettin ruokatorvea sairastavat potilaat arvioidaan ryhmänä, syöpäriskin on todettu olevan vain yksi 300 potilaasta vuodessa. Tämä tarkoittaa, että jos tutkisimme 300 potilasta vuosittain, yksi potilas sairastaisi syöpää joka vuosi. Meidän on todella tiedettävä syöpäriski, jos dysplasiaa ei löydy yhden tai kahden vuoden seurannan jälkeen. Uskomme, että tämä riski on paljon pienempi kuin aiemmin ilmoitetut luvut, joka on yksi 300 potilaasta vuodessa.
Potilailla, joilla on korkea-asteinen dysplasia, voidaan usein todeta syöpää. Siksi ensimmäinen hoitokerta, kun havaitaan korkealaatuista dysplasiaa, on sulkea pois adenokarsinooman esiintyminen.
Matala-asteinen dysplasia on paljon vähemmän uhkaava kuin korkea-asteinen dysplasia, mutta emme tiedä kuinka paljon vähemmän. Itse asiassa meillä ei ole tarkkoja tietoja osoittamaan, mikä syöpäriski on potilailla, joilla on Barrettin tauti ja matala-asteinen dysplasia.
Dysplasian diagnoosin tulee olla mahdollisimman tarkka, koska tämä diagnoosi voi saada aikaan muutoksen Barrettin ruokatorvea sairastavien potilaiden hoidossa tai seurannan intensiteetissä. Vaatii paljon kokemusta voidakseen tehdä tarkan diagnoosin dysplasian esiintymisestä ja asteesta. Siksi on yleinen ja hyödyllinen käytäntö pyytää toista patologia (tai jopa kolmatta tarvittaessa) tarkistamaan biopsiat. Ajatuksena on nähdä, ovatko patologit yksimielisiä ja/tai saada kokeneempi mielipide dysplasian esiintymisestä ja asteesta.
Jos henkilöllä on pidempi segmentti Barrettia, voisi arvata, että syöpäriski on suurempi kuin lyhyemmällä Barrettilla. Tiedot ovat kuitenkin tältä osin kiistanalaisia. Tästä syystä nykyinen käytäntö on tehdä endoskooppinen biopsiavalvonta samalla tiheydellä potilaille, joilla on lyhyt ja pitkä Barrettin ruokatorvi.
Barrettin ruokatorvella ei ole ainutlaatuisia oireita. Barrettin tautia sairastavilla potilailla on GERD-oireita (esimerkiksi närästys, regurgitaatio, pahoinvointi jne.). Yleinen suuntaus on Barrettin potilailla, joilla on vakavampi GERD. Kaikilla Barrettilla ei kuitenkaan ole merkittäviä GERD-oireita, ja joillakin potilailla GERD-oireet havaitaan vahingossa, ja GERD-oireet ovat vähäisiä tai ei ollenkaan.
Närästys on polttava tunne rintaluun takana, yleensä alaosassa, mutta voi ulottua aina kurkkuun asti. Joskus siihen liittyy polttoa tai kipua vatsan kuoppassa juuri sen alapuolella, missä rintaluun loppuu. Toinen yleisin oire on katkera makuusnesteen regurgitaatio (varmuuskopio). GERD-oireet ovat usein huonompi aterioiden jälkeen ja kun makaa tasaisesti.
Refluksoitunut, regurgitoitunut neste voi toisinaan päästä keuhkoihin tai kurkunpäähän, mikä johtaa niin kutsuttuihin ruokatorven ulkopuolisiin (ruokatorven ulkopuolisiin) GERD:n oireisiin (ilmiöihin). Näitä oireita ovat:
Syistä, joita ei täysin ymmärretä, joillakin GERD-potilailla on vähäistä närästystä, mutta heillä on muita GERD-oireita, esimerkiksi ruokatorven ulkopuolisia oireita.
GERD voi johtaa ruokatorven tiukuluihin ja haavaumiin. Ahtauma tai ahtautuminen johtuu ruokatorven arpeutumisesta (fibroosista), joka voi aiheuttaa nielemisvaikeuksia (dysfagia). Dysfagia aistitaan kiinteän ruoan takertumisena (pysähtymisenä) rinnassa (ruokatorvessa) ja nesteiden, kun ahtautuminen on vakava. Tärkeitä voidaan hoitaa venyttämällä ne laajennuksilla endoskopian aikana. Hoitamattomat ahtaumat voivat edistää ruoan ja/tai mahanesteiden vuotamista keuhkoihin. Melko harvoin voi esiintyä ruokatorven tulehduksesta johtuvaa massiivista maha-suolikanavan (GI) verenvuotoa. Tällainen verenvuoto johtaa veren oksentamiseen tai mustien tai kastanjanruskeiden ulosteiden kulkeutumiseen. Tulehtunut ruokatorvi voi kuitenkin yleisemmin aiheuttaa hidasta verenvuotoa, joka havaitaan, kun todetaan anemia (alhainen punasolujen määrä) ja/tai ulosteesta tehdään veritesti.
Barrettin ruokatorven oireiden lääketieteelliset hoidot ovat samat kuin GERD:n hoidot.
Hapon tukahduttaminen on GERD-hoidon selkäranka. Lieviin refluksioireisiin käytetään yleisesti käsikauppalääkkeitä, jotka vaihtelevat antasideista pieniin lääkkeisiin, joita kutsutaan H-2-reseptorin antagonisteiksi tai H2-salpaajiksi. Esimerkkejä reseptivapaista H2-salpaajista ovat simetidiini (Tagamet) ja famotidiini (Pepcid, Zantac 360). Pysyviä oireita varten voidaan käyttää suurempia (reseptivahvuisia) annoksia H-2-reseptorin salpaajia, esimerkiksi:
Protonipumpun estäjiä (PPI) käytetään kuitenkin jatkuviin oireisiin, jotka vaativat ylläpitohoitoa (jatkuvaa) tai komplisoituneessa GERD:ssä, johon liittyy ahtaumia tai verenvuotoa. Esimerkkejä PPI:istä ovat:
Jotkut potilaat tarvitsevat vain yhden pillerin päivässä, kun taas toiset tarvitsevat kaksi pilleriä (kaksinkertainen annos) oireiden hallitsemiseksi. Kaksinkertainen annos voidaan ottaa yhtenä pillerinä kahdesti päivässä tai 2 pillerinä kerran päivässä.
PPI:t ovat tehokkaita mahahapon erittymisen estäjiä. Ne lievittävät tehokkaasti närästystä ja parantavat ruokatorven tulehdusta (esofagiittia) ja happaman refluksin aiheuttamia ruokatorven haavaumia. PPI:t ovat hyvin siedettyjä, ja niillä on vain vähän sivuvaikutuksia. Näiden lääkkeiden lopettamisen jälkeen happorefluksioireet yleensä uusiutuvat, joskus voimakkaammin. Tämä oireiden lisääntyminen johtuu osittain hapon erityksen palautumisesta (hapon liikaeritys), joka on vastaus PPI:n aiheuttaman haponerityksen estämisestä toipumiseen.
PPI:iden pitkän aikavälin turvallisuus on tärkeä näkökohta. Although certain stomach tumors (carcinoids) were reported in experiments with older female rats, similar tumors have not been observed in people after more than 15 years of PPI use. In some people on long-term PPI therapy, small benign polyps (fundic gland polyps) may develop in the upper half of the stomach. However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. Näitä ovat:
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found
Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
 Onko IBS:n ja hedelmättömyyden välillä yhteyttä?
Onko IBS:n ja hedelmättömyyden välillä yhteyttä?
 Kuinka löytää oikeat ravitsemusohjeet terveen suoliston kannalta? Rekisteröityneet ravitsemusterapeutit kumoavat 5 yleistä suoliston terveyteen liittyvää myyttiä
Kuinka löytää oikeat ravitsemusohjeet terveen suoliston kannalta? Rekisteröityneet ravitsemusterapeutit kumoavat 5 yleistä suoliston terveyteen liittyvää myyttiä
 Terveysvinkki:tyrän ehkäisy
Terveysvinkki:tyrän ehkäisy
 Matala FODMAP-proteiinia sisältävät jauheet
Matala FODMAP-proteiinia sisältävät jauheet
 Probiootit adjuvanttina COVID-19-potilaille
Probiootit adjuvanttina COVID-19-potilaille
 5 hylättyä kolonoskopian myyttiä:COVID-19-versio
5 hylättyä kolonoskopian myyttiä:COVID-19-versio
 Schatzkis-sormus
Mikä on Schatzkin sormus? Mistä se johtuu? Schatzkin rengas on kuitumainen kudosnauha, joka kehittyy ruokatorven alaosassa ja supistaa sitä mahdollisesti pitkäaikaisen GERD. Schatzkin (Schatzkin)
Schatzkis-sormus
Mikä on Schatzkin sormus? Mistä se johtuu? Schatzkin rengas on kuitumainen kudosnauha, joka kehittyy ruokatorven alaosassa ja supistaa sitä mahdollisesti pitkäaikaisen GERD. Schatzkin (Schatzkin)
 Miksi Low FODMAP -ruokavalio lakkaa toimimasta
Tällä viikolla #AskADietitianissa käsittelimme, miksi Low FODMAP -ruokavalio lakkaa joskus toimimasta! Tämä voi olla TOSI turhauttavaa – mutta älä huoli – voit palata raiteilleen monella tapaa! Työsk
Miksi Low FODMAP -ruokavalio lakkaa toimimasta
Tällä viikolla #AskADietitianissa käsittelimme, miksi Low FODMAP -ruokavalio lakkaa joskus toimimasta! Tämä voi olla TOSI turhauttavaa – mutta älä huoli – voit palata raiteilleen monella tapaa! Työsk
 Mikrobit voivat ennustaa kuolemaan johtavia seurauksia hengitetyissä COVID-19-potilaissa
Läsnäolo Mycoplasma salivarium hengitettynä COVID-19-infektion sairastavien potilaiden alemmissa hengitysteissä liittyy lisääntynyt todennäköisyys kuolla. Tulos oli osa molekyylitutkimusta, jossa ta
Mikrobit voivat ennustaa kuolemaan johtavia seurauksia hengitetyissä COVID-19-potilaissa
Läsnäolo Mycoplasma salivarium hengitettynä COVID-19-infektion sairastavien potilaiden alemmissa hengitysteissä liittyy lisääntynyt todennäköisyys kuolla. Tulos oli osa molekyylitutkimusta, jossa ta