 10 % pacientų, sergančių GERL, išsivysto Bareto stemplė – stemplės vėžio rizikos veiksnys.
10 % pacientų, sergančių GERL, išsivysto Bareto stemplė – stemplės vėžio rizikos veiksnys.

Bareto stemplė neturi unikalių simptomų. Pacientams, sergantiems Bareto liga, pasireiškia GERL arba rūgšties refliukso simptomai:
Bareto stemplė yra lėtinės gastroezofaginio refliukso ligos (GERL) komplikacija, visų pirma baltiesiems vyrams. GERL yra liga, kurios metu rūgštus skystis iš skrandžio patenka į stemplę (rijimo vamzdelį). GERL dažniausiai sukelia rėmenį.
Bareto stemplės diagnozei keliami du reikalavimai. Dėl reikalavimų būtina atlikti stemplės endoskopiją. Endoskopijos metu per burną ir žemyn į stemplę įkišamas ilgas lankstus vamzdelis su šviesa ir kamera ant galo (endoskopas), kad būtų galima apžiūrėti ir paimti biopsiją (audinio mėginys iš) stemplės gleivinę. Du reikalavimai yra:
Bareto stemplė yra oficialiai užkoduota Kongreso bibliotekos elektroninėms literatūros paieškoms kaip Bareto stemplė, tačiau Bareto stemplė (su apostrofu „s“) yra visuotinai vartojamas pavadinimas. Būklė pavadinta chirurgo Normano Barretto, kuris apibūdino būklę, vardu. Tačiau pasirodo, kad jo išvadų interpretacija nebuvo teisinga. 1953 m. gydytojai Allison ir Johnstone iš tikrųjų apibūdino šią būklę taip, kaip mes ją suprantame dabar, ty metaplazija atsirado. (Metaplazija, apie kurią kalbama toliau, yra terminas, vartojamas, kai vienas suaugusio žmogaus audinys pakeičia kitą.) Nepaisant to, ši būklė buvo įamžinta Bareto vardu.
Iš pradžių buvo manoma, kad Bareto stemplę sudaro skrandžio (skrandžio) audinys, pakeičiantis įprastą plokščią stemplę dengiantį audinį. Tačiau aštuntojo dešimtmečio viduryje daktaras Paulas ir jo kolegos paskelbė straipsnį, kuriame išsamiau, nei buvo padaryta anksčiau, aprašė Bareto stemplės gleivinę (vidinį pamušalą). Jie nurodė, kad Bareto stemplė susideda iš metaplazijos, kurioje normalios stemplę dengiančios ląstelės buvo pakeistos skrandžio ir žarnyno gleivinės ląstelių mišiniu. Žarnyno tipo gleivinės ląstelės taip pat vadinamos specializuotomis stulpelinėmis ląstelėmis, kurios apima taurines ląsteles. Daugelį metų kai kurie mokslininkai manė, kad yra dviejų tipų Bareto ligos; viena, kurioje normali gleivinė buvo pakeista tik skrandžio (skrandžio) tipo ląstelėmis, o antroji – žarnyno ląstelių. Tačiau šiuo metu manoma, kad Bareto stemplės diagnozę lemia tik žarnyno tipo taurinių ląstelių buvimas, neatsižvelgiant į tai, kokių kitų ląstelių tipų yra.
Didelio susidomėjimo Bareto stemple priežastis yra ta, kad ji yra susijusi su padidėjusia stemplės vėžio rizika. Vėžio tipas, kuris pasireiškia pacientams, sergantiems Bareto liga, yra adenokarcinoma, atsirandanti iš metaplastinio žarnyno audinio. Įprastas stemplės vėžys, nesusijęs su Bareto liga, yra plokščioji karcinoma, atsirandanti iš plokščiųjų ląstelių gleivinės, kuri paprastai yra stemplėje. Ryšys tarp stemplės adenokarcinomos ir Bareto stemplės dabar yra aiškus, o stemplės adenokarcinoma dažnėja daugumoje Vakarų pusrutulio šalių.
Tačiau gera žinia ta, kad vėžys pasireiškia palyginti nedaugeliui pacientų, sergančių Bareto stemple. Vis dėlto pagrindinis šios būklės iššūkis yra stebėti ankstyvus įspėjamuosius vėžio požymius, reguliariai atliekant endoskopijos biopsijas. Ši praktika vadinama stebėjimu ir iš esmės yra panaši į moterų stebėjimą dėl gimdos kaklelio vėžio, kai PAP tepinėlis imamas reguliariais intervalais.
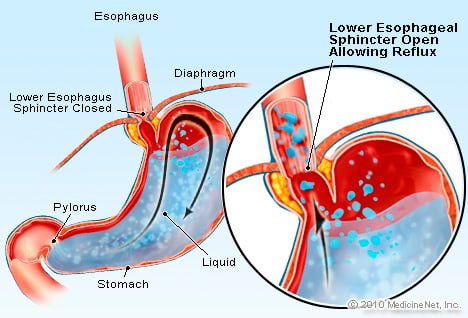
 GERL yra būklė, kai per didelis rūgšties turintis skystis grįžta (teka) atgal į stemplę, iš dalies dėl to, kad apatinis stemplės sfinkteris yra silpnas.
GERL yra būklė, kai per didelis rūgšties turintis skystis grįžta (teka) atgal į stemplę, iš dalies dėl to, kad apatinis stemplės sfinkteris yra silpnas. GERL sukelia Bareto stemplę. Stemplė yra raumeninis vamzdelis, esantis krūtinėje ir skirtas maistui pernešti iš burnos į skrandį. Apatinis stemplės sfinkteris (LES) yra vožtuvas, esantis skrandžio ir stemplės sankryžoje. Jo funkcija yra neleisti rūgščiai ir kitam skrandžio turiniui sugrįžti į stemplę. GERL yra būklė, kai per didelis rūgšties turintis skystis grįžta (teka) atgal į stemplę, iš dalies dėl to, kad apatinis stemplės sfinkteris yra silpnas. LES silpnumas iš dalies gali būti susijęs su tuo, kad beveik visi GERL pacientai turi hiatalinę išvaržą. Pacientams, sergantiems hiatal išvarža, keli viršutiniai skrandžio centimetrai per diafragmą slenka pirmyn ir atgal tarp pilvo ir krūtinės ląstos. Šis slydimas gali trukdyti sfinkterio veikimui kaip kliūtis refliuksui iš skrandžio į stemplę.
Anksčiau terminas išvarža buvo vartojamas vietoj GERL aiškinant pacientams jų simptomų (dažniausiai rėmens) pagrindą, nes beveik visi GERL sergantys pacientai turi hiatų išvaržas. Tačiau GERD yra tikslesnis terminas. Nors hiatal išvaržos yra labai dažnos gyventojų, tik nedaugeliui žmonių, sergančių hiatal išvarža, išsivysto GERL. Kitaip tariant, hiatal išvarža nereiškia, kad žmogui išsivystys GERL. Tačiau jei žmogus serga GERL, išvarža yra beveik visada.
Taigi Bareto stemplę sukelia lėtinis (daug metų trunkantis) ir dažniausiai sunkus rūgšties refliuksas. Kai kuriems pacientams, sergantiems GERL, stemplė reaguoja į pakartotinį rūgštinio skysčio sužalojimą, pakeisdama joje esančių ląstelių tipą iš plokščių (normalios ląstelės) į stulpelines (žarnyno tipo ląsteles). Manoma, kad ši transformacija, vadinama metaplazija, yra apsauginis atsakas, nes specializuotas Bareto stemplės koloninis epitelis (epitelis reiškia pamušalas) yra atsparesnis rūgšties pažeidimams nei plokščiasis epitelis.
Skrandžio skystyje yra rūgšties, kurią gamina skrandis. Be to, skystyje gali būti tulžies rūgščių (iš tulžies, kurią gamina kepenys) ir fermentų (kurių gamina kasa), kurie grįžta iš dvylikapirštės žarnos į skrandį. (Dvylikapirštė žarna yra pirmoji plonosios žarnos dalis už skrandžio.) Iš skrandžio į stemplę grįžtanti rūgštis kenkia stemplei. Tačiau yra įrodymų, kad tulžies ir kasos fermentai kartu su rūgštimi gali būti žalingesni nei vien rūgštis.
Didelė dalis asmenų, sergančių lėtiniais GERL simptomais, išsivysto Bareto stemple, ir tai dažniausiai pasitaiko Kaukazo vyrų populiacijose. Tačiau ne visi, sergantys GERL, turi GERL simptomų. Todėl kai kurie žmonės, sergantys Bareto liga, nežino, kad jie serga Bareto liga, nes jie serga GERL be jokių simptomų arba turi labai lengvus ir nedažnus simptomus.
Neaišku, kodėl Bareto stemplė baltiesiems vyrams yra tokia dažnesnė nei bet kuriai kitai grupei. Pavyzdžiui, nors atrodo, kad moterys ir afroamerikiečiai nėra apsaugoti nuo GERL išsivystymo, jie yra labai apsaugoti (ypač afroamerikiečiai) nuo Bareto stemplės ir Bareto vėžio (adenokarcinomos) išsivystymo. Yra įrodymų, kad vakarų pusrutulyje stemplės vėžys ir gastroezofaginės jungties vėžys (vadinamas širdies vėžiu) dažnėja, galbūt dažniau nei bet kuris kitas virškinimo trakto vėžys. (Tačiau gaubtinės žarnos vėžys vis dar yra daug dažnesnis nei stemplės vėžys.)
Bareto stemplė gali atsirasti kai kuriose šeimose ir būti genetiškai nulemta. Atliekami tyrimai, siekiant nustatyti, ar šiose šeimose galima rasti kokių nors genų ar žymenų, kurie numatytų Bareto stemplės vystymąsi bendroje populiacijoje. Šiose šeimose, kuriose serga Barrett, taip pat su Bareto liga, GERL yra bendras vardiklis. Tačiau kyla klausimas, kodėl Bareto liga šiose šeimose pasitaiko dažniau nei kitose, sergančiose panašiai sunkia GERL, tačiau neturinčios jokios šeimos sąsajos.
Pakartotinai, pirmasis Bareto stemplės diagnozavimo kriterijus yra endoskopijos metu aptiktas rausvas stemplės pamušalas, kurio paprastai nematyti. Šis nenormalus pamušalas gali atrodyti kaip juosta, panašus į liežuvį arba kaip salelės. Antrasis kriterijus yra tai, kad biopsijos iš rausvos pamušalo atskleidžia būdingą žarnyno gleivinę (pamušalas, paprastai matomas žarnyne) su tipiškomis taurių ląstelėmis. Endoskopijos metu paimamos stemplės biopsijos. Viršutinė virškinimo trakto endoskopija yra procedūra, kurios metu gydytojas įkiša ilgą lankstų vamzdelį (endoskopą) per burną ir žemyn į stemplę, kad būtų galima tiesiogiai vizualizuoti stemplės gleivinę. To paties endoskopinio tyrimo metu taip pat galima vizualizuoti skrandį ir dvylikapirštę žarną. Per endoskopą galima paimti kelis nedidelius epitelio audinio mėginius (biopsijas).
Kaip minėta anksčiau, vieno tipo audinių pamušalo pakeitimo kitu procesas vadinamas metaplazija. Skrandyje ir žarnyne metaplazija yra įprastas atsakas į tam tikrų rūšių sužalojimus. Patologas Henry Appelmanas teigė:„Kai žarnynas patiria stresą, jis nori būti kuo nors kitu“. Kiti metaplazijos, kai viena gleivinė pakeičiama kita, pavyzdžiai:(1) skrandyje, kur lėtinis uždegimas (gastritas) gali sukelti žarnyno tipo gleivinę, pakeičiančią normalios skrandžio gleivinės dalis; ir (2) dvylikapirštėje žarnoje (šiek tiek už skrandžio žarnyne), kur atsiranda pepsinės opos, o opą supanti žarnyno gleivinė virsta skrandžio tipo gleivine.
Manome, kad metaplazijos procesas yra apsauginė arba prisitaikanti reakcija į gleivinės pažeidimą. Tačiau metaplazijos neigiama pusė yra ta, kad Bareto stemplėje ji šiek tiek, bet aiškiai padidina riziką susirgti vėžiu. Ne visos metaplazijos padidina vėžio riziką. Pavyzdžiui, iš dviejų ankstesnėje pastraipoje nurodytų metaplazijų žarnyno metaplazija skrandyje gali sukelti vėžį, tačiau žarnyno metaplazija dvylikapirštėje žarnoje – ne.
Bareto vystymosi procesas prasideda skrandžio ir stemplės gleivinės sankryžoje. Stemplė paprastai yra išklota plokščiu epiteliu arba pamušalu. Šis plokščiasis epitelis yra perlamutriškai baltos spalvos, o skrandžio ir žarnyno gleivinė yra labiau lašišos rausvos spalvos, nes tai yra stulpelinis epitelis, o ne plokščias epitelis. Plokščiasis epitelis sudarytas iš plokščių plokščių ląstelių, panašių į odos ląsteles. Skrandžio arba skrandžio gleivinė susideda iš aukštesnių stulpelių ląstelių, kaip matyti po mikroskopu. Stemplės plokščiojo epitelio ir skrandžio stulpelio epitelio jungtis atsiranda stemplės ir skrandžio sandūroje, kur, kaip prisimenate, yra apatinis stemplės sfinkteris. Šių dviejų pamušalų bendra kraštinė (sąsaja) dažnai vadinama Z linija, nes tiriant endoskopijos metu ji atrodo zigzago pavidalu.
Laipsniškai pažeidžiant stemplę, atsiranda metaplazija ir metaplastinis audinys juda aukštyn stemple atstumu, kuris skiriasi nuo žmogaus iki žmogaus, paprastai nuo 0,5 iki 2,5 colio (apie 1–6 centimetrų). Ląstelės, kuri sukelia metaplastinį audinį, tipas nežinomas.
Bareto stemplė dažnai skirstoma į trumpo arba ilgo segmento Bareto stemplę, atsižvelgiant į paveiktos stemplės ilgį. Trumpas Bareto segmentas paprastai reiškia 3 centimetrų ar mažesnį stemplės pažeidimą, o ilgas segmentas reiškia daugiau nei 3 centimetrų stemplės įtraukimą. Įdomu tai, kad kai pacientui diagnozuojama Bareto stemplė, neatrodo, kad metaplastinis pamušalas toliau progresuotų į stemplę, jei pacientas gydomas nuo GERL. Taigi laikui bėgant bendravimo su Barretto trukmė paprastai išlieka tokia pati.
Jei biopsijos imamos iš pacientų, sergančių GERL, kurių Z linija yra normali (nėra matomų Bareto stemplės požymių), iki 30 % pacientų bus parodyta tokia pati žarnyno tipo metaplazija su taurelių ląstelėmis, kaip ir Bareto stemplėje. Tačiau mes reguliariai neatliekame įprastų Z linijų biopsijos, kad ieškotume šio pokyčio, ir neatliekame stebėjimo, kai jį ten randame. Priežastis ta, kad ribota žarnyno metaplazija gastroezofaginės jungties regione sergant GERL moterims ir afroamerikiečiams pasireiškia panašiai kaip ir baltiesiems vyrams, tačiau atviros Bareto stemplės rizika yra daug mažesnė nei baltiesiems vyrams.
Todėl metaplazijos buvimas įprastinės normalios Z linijos biopsijoje sergant GERL neturėtų sukelti jokių valdymo pokyčių. Be to, taurinių ląstelių radimas šiame kontekste neturėtų būti pažymėtas, kaip kai kurie siūlė, itin trumpu Bareto segmentu. Pagrindinė priežastis, kodėl ji nepažymėta kaip Bareto liga, yra ta, kad terminas Baretas reiškia padidėjusią vėžio riziką, ir nėra įrodymų, kad ši išvada būtų susijusi su padidėjusia vėžio rizika.
Vėžio tipas, atsirandantis su Bareto stemple, yra adenokarcinoma. Vėžys, atsirandantis dėl plokščiosios stemplės gleivinės, vadinamas plokščiuoju vėžiu arba karcinoma. Tarp baltaodžių plokščiojo vėžio dažnis (dažnis laikui bėgant) mažėja, palyginti su su Bareto liga susijusia adenokarcinoma. Tačiau kitos rasinės grupės (pavyzdžiui, afroamerikiečiai) nepatyrė tokio paties plokščiojo vėžio skaičiaus mažėjimo, palyginti su adenokarcinoma.
Rūkymas ir per didelis alkoholio vartojimas yra neabejotini suragėjusio vėžio rizikos veiksniai. Jie taip pat yra Bareto stemplės adenokarcinomos rizikos veiksniai. Tačiau šioje situacijoje neaišku, ar rūkymas ir alkoholis padidina adenokarcinomos riziką, nes GERL tampa sunkesnė, ar rūkymas ir alkoholis turi tiesioginį vėžį sukeliantį poveikį, kaip tai būna plokščiojo vėžio atveju. Suragėjusių ląstelių vėžys vis retesnis, o adenokarcinomos diagnozių padaugėjo. Baltaodžių vyrų adenokarcinomos dažnis išaugo labiau nei kitose etninėse grupėse.
Visoje likusioje šio skyriaus dalyje terminas stemplės vėžys reiškia adenokarcinomą, atsirandančią iš Bareto stemplės.
Gastroezofaginės jungties vėžys taip pat vadinamas širdies vėžiu, nes sritis, kurioje stemplė susikerta su skrandžiu, vadinama kardija. Šis vėžys, kaip ir su Bareto liga susijusi adenokarcinoma, dažniausiai randamas baltiesiems vyrams, jo dažnis didėja taip pat, kaip ir stemplės vėžys, ir yra susijęs su lėtine GERL. Todėl spėjama, kad širdies vėžys prasideda nuo trumpų (pavyzdžiui, 1–2 cm) Bareto segmentų. Tačiau tuo metu, kai diagnozuojamas vėžys, auglys gali būti išplitęs už trumpojo Bareto segmento ir gali pasirodyti esantis širdyje. Tačiau šios spėlionės apie širdies vėžio kilmę dar turi būti įrodytos.
Mažiausiai 20 metų stebimas stemplės adenokarcinomos padažnėjimas, visų pirma baltiesiems vyrams. Vienas iš šios tendencijos priežasčių gali būti susijęs su H dažnio sumažėjimu. pylori skrandžio infekcija. Kitaip tariant, žmonėms, sergantiems Bareto vėžiu, įskaitant širdies vėžį, H. pylori infekcija nei kiti to paties amžiaus ir lyties asmenys toje pačioje populiacijoje.
H. pylori yra bakterijų rūšis, kuri yra pagrindinė opų priežastis. Tai labai paplitusi infekcija visame pasaulyje ir daugumai sergančių žmonių nesukelia jokių simptomų. Tačiau kai kurie žmonės, turintys H. pylori išsivysto skrandžio ir dvylikapirštės žarnos pepsinė opa. Šios opos gydomos pašalinant bakterijas, kurios savo ruožtu apsaugo nuo opų atkryčio.
Jei H. pylori negydoma, sukelia progresuojantį skrandžio uždegimą (gastritą), kuris yra susijęs su rūgšties sekrecijos sumažėjimu ir galbūt mažesniu rūgšties refliuksu į stemplę. Daugelyje pasaulio vietų šios infekcijos dažnis mažėja, tikriausiai dėl geresnių visuomenės sveikatos priemonių. Todėl gali būti, kad apsauginis poveikis (pvz., sumažėjusi rūgšties gamyba) lėtinės H. pylori infekcija sumažėjo. Kitaip tariant, su mažiau H. pylori gastritas, skrandis gamina daugiau rūgšties ir daugiau rūgšties grįžta į stemplę. Tuo pačiu metu vyresniame amžiuje esame labiau linkę į refliuksą. Nors tai nėra išspręsta, mažėjantis H dažnis. pylori infekcija gali būti viena iš priežasčių, kodėl vis dažniau sergama su Bareto liga susijusi adenokarcinoma.
Displazija – tai stemplę išklojančių ląstelių pakitimas, kai ląstelės iš tikrųjų rodo nenormalius savo struktūros ir išvaizdos pokyčius. Kai šie pokyčiai tampa pakankamai sunkūs (nuo žemos iki didelės displazijos), ląstelės pradeda atrodyti piktybinės (kaip vėžio ląstelės). Tačiau, skirtingai nei vėžys, šios ląstelės lieka vietoje ir neįsiveržia į audinius, esančius už pamušalo ribų. Displazija atsiranda kaip ląstelių pokyčių serija, kai Bareto stemplė progresuoja į su Bareto susijusį vėžį. Pacientai, sergantys Bareto liga, yra stebimi atliekant endoskopiją ir biopsijas (stebėjimą), siekiant nustatyti šiuos ląstelių pokyčius (displaziją) arba, blogiausiu atveju, ankstyvą vėžį, kad būtų galima juos gydyti. Šiuo metu nėra galimybės numatyti, kuriems Bareto stemple sergantiems pacientams išsivystys displazija.
Displazija taip pat buvo nustatyta šalia virškinimo trakto navikų, išskyrus stemplės adenokarcinomą. Pavyzdžiui, displazija nustatoma pusei skrandžio vėžio atvejų ir storosios žarnos vėžio atveju, kai displazija matoma kaip vadinamieji adenomatiniai polipai. Be to, displazija yra toks pat ankstyvas perspėjantis ląstelių pokytis, kurio patologai ieško PAP tepinėliuose iš gimdos kaklelio, kurie prognozuoja gimdos kaklelio vėžį.
Displazija laikoma ikivėžiniu. Tai reiškia, kad jei displazija buvo įrodyta keletą kartų, manoma, kad pacientas susirgs vėžiu, jei gyvens pakankamai ilgai. Displazija skirstoma į aukšto laipsnio arba žemo laipsnio. Kai diagnozuojama didelio laipsnio displazija, vėžys jau gali būti, o jei ne, rizika susirgti vėžiu anksčiau yra didesnė nei esant mažesnio laipsnio displazijai.
Tolesnėse displazija sergančių pacientų biopsijose kai kuriems pacientams ši būklė gali būti nenustatyta, o kitiems randama nedidelio laipsnio displazija. Tokį displazijos nebuvimą arba sumažėjimą gali lemti tokie veiksniai kaip mėginių ėmimo pokyčiai, mažų displazijos židinių (ląstelių grupių) pašalinimas atliekant pradinę biopsiją arba tikrasis biologinis pasikeitimas. Tiksli priežastis (-ys) nežinoma.
Naudojant molekulinius metodus, kai kurie pokyčiai, vadinami biomarkeriais, gali būti aptikti biopsijos mėginiuose prieš displazijos atsiradimą. Šie pokyčiai yra panašūs į tuos, kurie stebimi sergant kitomis vėžio formomis. Biomarkeriai apima ląstelių DNR kiekio, genų ir chromosomų bei augimo faktorių pokyčius. Gali būti įrodyta, kad daugelis šių biologinių žymenų atsiranda prieš displazijos atsiradimą ir jos metu. Galutinis tikslas yra rasti stebuklingą žymeklį, kuris galėtų mums pasakyti, kurie pacientai iš tų, kuriems nėra displazija ar žemo laipsnio displazija, yra labiau linkę susirgti didelio laipsnio displazija ar vėžiu. Tokius pacientus galima stebėti atidžiau nei kitus.
Šiuo metu visi pacientai, sergantys Bareto stemple, stebėjimo požiūriu, gydomi vienodai. Biologinių žymenų prieinamumas atskirtų (susluoksniuotų) Barretto pacientus pagal jų riziką susirgti vėžiu. Toks stratifikavimas leistų gydytojams dažniau atlikti stebėjimo endoskopiją ir biopsijas mažumai pacientų, kuriems gresia didesnė vėžio rizika, ir rečiau tiems, kuriems prognozuojama mažesnė vėžio rizika.
Kitas patikrintų biologinių žymenų panaudojimas būtų padėti patvirtinti patologo pateiktą displazijos interpretaciją biopsijose.
Kai pacientai, sergantys Bareto stemple, vertinami kaip grupė, nustatyta, kad vėžio rizika yra tokia maža kaip vienam iš 300 pacientų per metus. Tai reiškia, kad jei kasmet ištirtume 300 pacientų, kasmet būtų nustatytas vienas pacientas, sergantis vėžiu. Ką tikrai turime žinoti, yra vėžio rizika, jei po vienerių ar dvejų metų stebėjimo displazija nenustatoma. Manome, kad ši rizika būtų daug mažesnė nei anksčiau pateikti skaičiai – vienas iš 300 pacientų per metus.
Pacientams, sergantiems didelio laipsnio displazija, dažnai gali būti nustatytas vėžys. Todėl pirmasis gydymo būdas, kai nustatoma didelio laipsnio displazija, yra pašalinti adenokarcinomos buvimą.
Žemo laipsnio displazija yra daug mažiau grėsminga nei aukšto laipsnio displazija, bet mes nežinome, kiek mažiau. Tiesą sakant, mes neturime tikslių duomenų, kad būtų galima nurodyti, kokia yra vėžio rizika pacientams, sergantiems Bareto liga ir mažo laipsnio displazija.
Displazijos diagnozė turėtų būti kuo tikslesnė, nes ši diagnozė gali paskatinti pakeisti gydymą arba pacientų, sergančių Bareto stemple, stebėjimo intensyvumą. Norint tiksliai diagnozuoti displazijos buvimą ir laipsnį, reikia daug patirties. Todėl įprasta ir naudinga praktika yra prašyti antrojo patologo (jei reikia, net ir trečio) peržiūrėti biopsijas. Idėja yra išsiaiškinti, ar patologai sutaria ir (arba) gauti labiau patyrusią nuomonę apie displazijos buvimą ir laipsnį.
Jei žmogus turi ilgesnio segmento Barretto, galima spėti, kad vėžio rizika yra didesnė nei su trumpesnio segmento Bareto liga. Tačiau duomenys šiuo atžvilgiu yra prieštaringi. Dėl šios priežasties dabartinė praktika yra panašiai dažnai atlikti endoskopinės biopsijos stebėjimą pacientams, kurių Bareto stemplė yra trumpa ir ilga.
Bareto stemplė neturi unikalių simptomų. Pacientams, sergantiems Bareto liga, pasireiškia GERL simptomai (pvz., rėmuo, regurgitacija, pykinimas ir kt.). Bendra tendencija yra ta, kad Barretto pacientai serga sunkesniu GERL. Tačiau ne visiems Barretto pacientams būdingi ryškūs GERL simptomai, o kai kurie pacientai atsitiktinai aptinkami su minimaliais GERL simptomais arba jų visai nėra.
Rėmuo yra deginimo pojūtis už krūtinkaulio, dažniausiai apatinėje dalyje, bet gali prasidėti iki pat gerklės. Kartais tai lydi deginimas ar skausmas skrandžio duobėje, esančioje žemiau, kur baigiasi krūtinkaulis. Antras dažniausias simptomas yra kartaus skonio skysčio regurgitacija (atsarginė). GERL simptomai dažnai pablogėja pavalgius ir gulint.
Reflukso, regurgituotas skystis retkarčiais gali patekti į plaučius arba balso dėžutę (gerklą), sukeldamas vadinamuosius ekstrastemplinius (už stemplės ribų) GERL simptomus (apraiškas). Šie simptomai yra:
Dėl ne visiškai suprantamų priežasčių kai kuriems GERL sergantiems pacientams rėmuo yra minimalus, tačiau jie patiria kitus GERL simptomus, pavyzdžiui, ekstrastemplės simptomus.
GERL gali sukelti stemplės susiaurėjimą ir išopėjimą. Susiaurėjimas arba susiaurėjimas atsiranda dėl stemplės randų (fibrozės), dėl kurio gali pasunkėti rijimas (disfagija). Disfagija jaučiama kaip kieto maisto prilipimas (sustabdymas) krūtinėje (stemplėje), o skysčiai, kai susiaurėjimas yra stiprus. Striktūras galima gydyti endoskopijos metu ištempiant jas dilatatoriais. Negydomos striktūros gali paskatinti daugiau maisto ir (arba) skrandžio skysčių išsiliejimo į plaučius. Nedažnai gali pasireikšti masinis kraujavimas iš virškinimo trakto (GI), kurį sukelia stemplės uždegimas. Dėl tokio kraujavimo atsiranda vėmimas krauju arba juodos arba kaštoninės išmatos. Tačiau dažniau uždegusi stemplė gali sukelti lėtą kraujavimą, kuris nustatomas nustačius anemiją (sumažėjusį raudonųjų kraujo kūnelių skaičių) ir (arba) ištyrus kraują išmatose.
Bareto stemplės simptomų gydymas yra toks pat, kaip ir GERL.
Rūgšties slopinimas yra GERL gydymo pagrindas. Esant lengviems refliukso simptomams, dažniausiai naudojami nereceptiniai vaistai – nuo antacidinių vaistų iki mažų dozių vaistų, vadinamų H-2 receptorių antagonistais arba H2 blokatoriais. Nereceptinių H2 blokatorių pavyzdžiai yra cimetidinas (Tagamet) ir famotidinas (Pepcid, Zantac 360). Jei simptomai neišnyksta, gali būti naudojamos didesnės (receptinio stiprumo) H-2 receptorių antagonistų vaistų dozės, pavyzdžiui:
Tačiau esant nuolatiniams simptomams, kuriems reikalinga palaikomoji (tęstinė) terapija, arba esant komplikuotai GERL su susiaurėjimu ar kraujavimu, naudojami protonų siurblio inhibitoriai (PSI). PSI pavyzdžiai:
Kai kuriems pacientams reikia išgerti tik vieną tabletę per dieną, o kitiems reikia dviejų tablečių (dvigubos dozės) simptomams kontroliuoti. Dvigubą dozę galima gerti kaip vieną tabletę du kartus per parą arba 2 tabletes vieną kartą per parą.
PSI yra stiprūs rūgšties sekrecijos iš skrandžio inhibitoriai. Jie veiksmingai malšina rėmenį ir gydo stemplės uždegimą (ezofagitą) ir stemplės opas, kurias sukelia rūgšties refliuksas. PSI yra gerai toleruojami ir sukelia nedaug šalutinių poveikių. Nutraukus šių vaistų vartojimą, rūgšties refliukso simptomai dažniausiai kartojasi, kartais sustiprėja. Šis simptomų padidėjimas iš dalies atsiranda dėl rūgšties sekrecijos atsigavimo (rūgšties hipersekrecijos), kuri yra atsakas, sukeltas atsigavimo po PSI slopinančio rūgšties sekreciją.
Svarbus aspektas yra ilgalaikis PSI saugumas. Although certain stomach tumors (carcinoids) were reported in experiments with older female rats, similar tumors have not been observed in people after more than 15 years of PPI use. In some people on long-term PPI therapy, small benign polyps (fundic gland polyps) may develop in the upper half of the stomach. However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. Tai apima:
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found
Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
 Ar „Paleo“ arba „SCD“ veiks man?
Neseniai socialiniame tinkle „Facebook“ paskelbiau šią savo nuotrauką sporto salėje... ne todėl, kad mėgstu stovėti prieš veidrodį ir žiūrėti į save, o todėl, kad nekenčiau ten būti tą vakarą. Kiekvi
Ar „Paleo“ arba „SCD“ veiks man?
Neseniai socialiniame tinkle „Facebook“ paskelbiau šią savo nuotrauką sporto salėje... ne todėl, kad mėgstu stovėti prieš veidrodį ir žiūrėti į save, o todėl, kad nekenčiau ten būti tą vakarą. Kiekvi
 Pasiruošimas kolonoskopijai
Kaip pasiruošti kolonoskopijai Ruošiantis kolonoskopijai, labai svarbu atidžiai laikytis visų nurodymų. Informacijos paketą gausite pirminės konsultacijos pas virškinimo priežiūros gydytojus, kurių b
Pasiruošimas kolonoskopijai
Kaip pasiruošti kolonoskopijai Ruošiantis kolonoskopijai, labai svarbu atidžiai laikytis visų nurodymų. Informacijos paketą gausite pirminės konsultacijos pas virškinimo priežiūros gydytojus, kurių b
 Kaip nepirkti netikro ir apkarsto alyvuogių aliejaus
Neseniai kalbėjome apie tai, kokie svarbūs sveikatai yra polifenoliai. Pamiršome pakalbėti apie vieną didžiausių šaltinių, kuriuos gali valgyti ir turėtų valgyti beveik visi, turintys žarnyno proble
Kaip nepirkti netikro ir apkarsto alyvuogių aliejaus
Neseniai kalbėjome apie tai, kokie svarbūs sveikatai yra polifenoliai. Pamiršome pakalbėti apie vieną didžiausių šaltinių, kuriuos gali valgyti ir turėtų valgyti beveik visi, turintys žarnyno proble