 Tyktarmskræft er den tredje hyppigste årsag til kræft i USA
Tyktarmskræft er den tredje hyppigste årsag til kræft i USATegn og symptomer på tyktarmskræft har en tendens til ikke at være specifikke. Med andre ord kan tegnene og symptomerne opstå på grund af en række forskellige tilstande. Når tyktarmskræft opdages i de tidlige stadier, har det muligvis ikke engang forårsaget symptomer. Symptomer kan også variere afhængigt af det specifikke sted i tyktarmen, hvor tumoren er placeret.
Nogle symptomer og tegn på tyktarmskræft er:

Hver dag i vores kroppe sker en massiv proces med ødelæggelse og reparation. Den menneskelige krop består af omkring 15 billioner celler, og hver dag milliarder af celler slides eller ødelægges. I de fleste tilfælde, hver gang en celle ødelægges, laver kroppen en ny celle til at erstatte den og forsøger at lave en celle, der er en perfekt kopi af den celle, der blev ødelagt, fordi erstatningscellen skal være i stand til at udføre den samme funktion som ødelagt celle. Under den komplekse proces med at udskifte celler opstår der mange fejl. På trods af bemærkelsesværdigt elegante systemer på plads til at forhindre fejl, laver kroppen stadig titusindvis af fejl dagligt, mens den udskifter celler enten på grund af tilfældige fejl, eller fordi der er udefrakommende pres på udskiftningsprocessen, der fremmer fejl. De fleste af disse fejl korrigeres af yderligere elegante systemer, eller fejlen fører til, at den nyoprettede celle dør, og en anden normal ny celle produceres. Nogle gange begår der dog en fejl, som ikke bliver rettet. Mange af de ukorrigerede fejl har ringe effekt på helbredet, men hvis fejlen tillader den nyfremstillede celle at dele sig uafhængigt af de kontroller og balancer, der styrer normal cellevækst, kan den celle begynde at formere sig på en ukontrolleret måde. Når dette sker, kan en tumor (i det væsentlige en masse af unormale celler) udvikle sig.
Tumorer falder i to kategorier:der er godartede (ikke-cancerøse) tumorer og ondartede (cancerøse) tumorer. Så hvad er forskellen? Svaret er, at en godartet tumor kun vokser i det væv, hvorfra den opstår. Godartede tumorer kan nogle gange vokse ret store eller hurtigt og forårsage alvorlige symptomer, endda død, selvom de fleste ikke gør det. For eksempel er en fibroid tumor i en kvindes livmoder en type godartet tumor. Det kan forårsage blødning eller smerte, men det vil aldrig rejse uden for livmoderen og vokse som en ny tumor andre steder. Fibromer, som alle godartede tumorer, mangler kapacitet til at kaste celler ind i blodet og lymfesystemet, så de er ude af stand til at rejse til andre steder i kroppen og vokse. En kræftsygdom kan på den anden side udskille celler, der kan rejse gennem blodet eller lymfesystemet, lande i væv fjernt fra den primære tumor og vokse til nye tumorer i disse fjerne væv. Denne spredningsproces til fjerne væv, kaldet metastase, er den definerende karakteristik af en kræft- eller ondartet tumor.
Godartede tumorceller ser ofte relativt normale ud, når de undersøges under mikroskop. Ondartede celler eller kræftceller ser normalt mere unormale ud, når de ses på samme måde under mikroskopet.
Kræft er en gruppe på mere end 100 forskellige sygdomme, ligesom infektionssygdomme. Kræfter er navngivet af de væv, hvorfra den første tumor opstår. Derfor er en lungekræft, der rejser til leveren, ikke en leverkræft, men beskrives som lungekræft, der metastaserer leveren, og en brystkræft, der spreder sig til hjernen, beskrives ikke som en hjernetumor, men snarere som brystkræft, der metastaserer til hjerne. Hver kræftsygdom er en anden sygdom med forskellige behandlingsmuligheder og varierende prognoser (sandsynlige udfald eller forventet levetid). Faktisk har hvert individ med kræft en unik sygdom, og den relative succes eller mangel på behandling blandt patienter med samme diagnose kan være meget forskellig. Som følge heraf er det vigtigt at behandle hver person med en kræftdiagnose som individ uanset kræfttypen.
 Billede af tyktarmskræft (kolorektal).
Billede af tyktarmskræft (kolorektal).
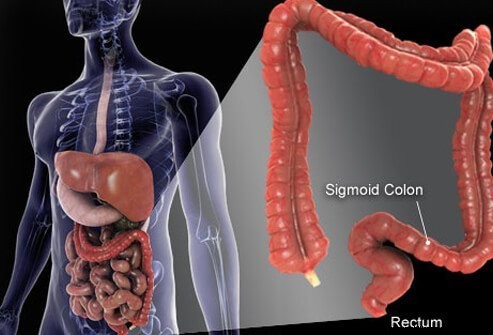
Tyktarmen og endetarmen er de sidste dele af røret, der strækker sig fra munden til anus. Maden kommer ind i munden, hvor den tygges og derefter synkes. Det rejser derefter gennem spiserøret og ind i maven. I maven males maden til mindre partikler og kommer derefter nøje kontrolleret ind i tyndtarmen. I tyndtarmen sker den endelige fordøjelse af maden og optagelsen af næringsstofferne i maden. Den mad, der ikke fordøjes og absorberes, kommer ind i tyktarmen (tyktarmen) og til sidst i endetarmen. Tyktarmen fungerer primært som opbevaringssted for affald; dog fjernes yderligere vand, salte og nogle vitaminer yderligere. Derudover fordøjes noget af den ufordøjede mad, for eksempel fibre, af tyktarmsbakterier, og nogle af fordøjelsesprodukterne optages fra tyktarmen og ind i kroppen. (Det anslås, at 10 % af energien fra mad kommer fra disse produkter af bakteriel fordøjelse i tyktarmen.) Den resterende ufordøjede mad, døende celler fra slimhinden i tarmene og et stort antal bakterier lagres i tyktarmen og derefter periodisk passeret ind i endetarmen. Deres ankomst til endetarmen starter en afføring, der tømmer tyktarmens indhold fra kroppen som afføring.
Selvom tyktarmen er et rør, er det strukturelt et kompliceret rør, mere som et radialdæk med stålbælte end en haveslange. Røret består af fire lag. Det første er et indre lag af celler, der beklæder hulrummet, hvorigennem den ufordøjede og fordøjende mad bevæger sig, kaldet slimhinden. Slimhinden er knyttet til et tyndt andet lag, submucosa, der er knyttet til et muskellag, muscularis. Hele røret er omgivet af fibrøst (ar-lignende) væv kaldet serosa. De mest almindelige kræftformer i tyktarmen (den type kaldet adenocarcinom) opstår fra slimhinden, det indre lag af celler. Disse celler udsættes for toksiner fra fødevarer og bakterier samt mekanisk slid, og de vender relativt hurtigt om (dør af og erstattes). Fejl (normalt en række fejl, der involverer gener i erstatningscellerne) fører til unormale celler og ukontrolleret spredning af de unormale celler, der giver anledning til kræft. Den hurtige omsætning gør det muligt at opstå flere fejl sammenlignet med væv, der ikke vender så hurtigt (f.eks. levervæv).
Det meste af tyktarmen hviler inde i et hulrum i maven kaldet bughulen. Dele af tyktarmen er i stand til at bevæge sig ganske frit i bughulen, når den ufordøjede føde passerer gennem den. Når tyktarmen går mod endetarmen, bliver den fikseret til vævene bag bughulen, et område kaldet retroperitoneum. Den ende del af tyktarmen, den del, der ligger i retroperitoneum, er endetarmen. I modsætning til meget af resten af tyktarmen, er endetarmen fikseret på plads af det væv, der omgiver den. På grund af sin placering er behandling for endetarmskræft ofte anderledes end behandling for kræft i resten af tyktarmen.
 Billede af kolontværsnit.
Billede af kolontværsnit. 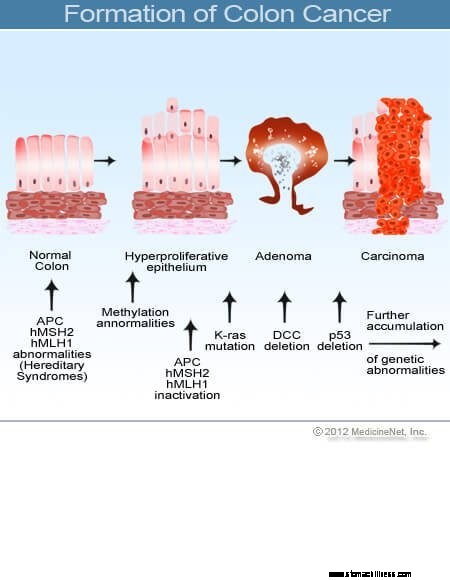 Billede af dannelse af tyktarmskræft.
Billede af dannelse af tyktarmskræft.
Den menneskelige tyktarm (tyktarm) er omkring 6 fod lang.
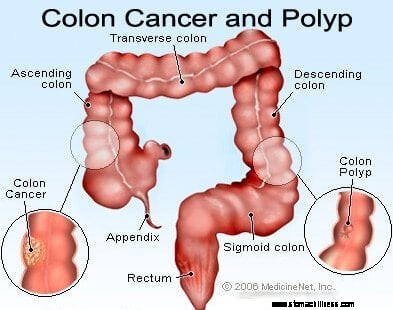
Kræft i tyktarmen og endetarmen (kolorektal cancer) starter, når processen med den normale udskiftning af tyktarmsceller går skævt. Fejl i celledeling forekommer hyppigt. Af grunde, der er dårligt forstået, opstår der nogle gange fejl, der undslipper vores redigeringssystemer. Når dette sker, begynder disse celler at dele sig uafhængigt af de normale kontroller og balancer, der styrer væksten. Da disse unormale celler vokser og deler sig, kan de føre til vækst i tyktarmen kaldet polypper. Polypper varierer i type, men mange er præcancerøse tumorer, der vokser langsomt i løbet af årene og ikke spredes. Efterhånden som polypper vokser, destabiliserer yderligere genetiske mutationer cellerne yderligere. Når disse præcancerøse tumorer ændrer retning (vokser ind i væggen af røret i stedet for i rummet i midten af det) og invaderer andre lag af tyktarmen (såsom submucosa eller muskulært lag), er den præcancerøse polyp blevet kræft. I de fleste tilfælde er denne proces langsom, og det tager mindst otte til 10 år at udvikle sig fra de tidlige afvigende celler til en ærlig cancer. Kolorektal cancer er typisk et adenocarcinom, et udtryk, der refererer til en cancer, der er dannet i visse typer af slimhindevæv i kroppen.
Når en tyktarmskræft først dannes, begynder den at vokse på to måder. For det første kan kræften vokse lokalt og strække sig gennem væggen af tarmen og invadere tilstødende strukturer, hvilket gør massen (kaldet den primære tumor) mere et problem og sværere at fjerne. Lokal forlængelse kan forårsage yderligere symptomer såsom smerte eller fylde, perforering af tyktarmen eller blokeringer af tyktarmen eller nærliggende strukturer. For det andet, efterhånden som kræften vokser, begynder den processen med metastase, og udskiller tusindvis af celler om dagen i blodet og lymfesystemet, som kan forårsage dannelse af kræft i fjerne steder. Kolorektale kræftformer spredes oftest først til lokale lymfeknuder, før de rejser til fjerne organer. Når lokale lymfeknuder er involveret, er spredning til leveren, bughulen og lungen de næstmest almindelige destinationer for metastatisk spredning.
Kolorektal cancer er den tredjehyppigste årsag til kræft i USA hos både mænd og kvinder. Det påvirker over 135.000 mennesker årligt, hvilket repræsenterer 8% af alle kræfttilfælde. Omkring 4,3 % af mennesker vil blive diagnosticeret med tyktarms- eller endetarmskræft på et tidspunkt i deres liv.
Ved at klikke på "Send" accepterer jeg MedicineNets vilkår og betingelser og privatlivspolitik. Jeg accepterer også at modtage e-mails fra MedicineNet, og jeg forstår, at jeg til enhver tid kan fravælge MedicineNet-abonnementer.
Sundhedspersonale er sikre på, at kolorektal cancer ikke er smitsom (en person kan ikke få sygdommen fra en cancerpatient). Nogle mennesker er mere tilbøjelige til at udvikle tyktarmskræft end andre. Faktorer, der øger en persons risiko for tyktarmskræft omfatter stigende alder, afroamerikansk race, højt fedtindtag, en familiehistorie med tyktarmskræft og polypper, tilstedeværelsen af polypper i tyktarmen og inflammatoriske tarmsygdomme, primært kronisk colitis ulcerosa.
Stigende alder er den vigtigste risikofaktor for tyktarmskræft. Omkring 90 % af kolorektale kræfttilfælde diagnosticeres efter 50 års alderen.
Afroamerikanere har en højere forekomst af tyktarmskræft end mennesker af andre racer.
Diæter med højt fedtindhold har i adskillige forskningsundersøgelser vist sig at disponere mennesker for tyktarmskræft. I lande med høj forekomst af tyktarmskræft er befolkningens fedtindtag meget højere end i lande med lav forekomst af kræft. Det menes, at fordøjelsen af fedt, der sker i tyndtarmen og tyktarmen, fører til dannelsen af kræftfremkaldende kemikalier (kræftfremkaldende stoffer). Ligeledes viser forskningsundersøgelser også, at diæter med højt indhold af grøntsager og fiberrige fødevarer såsom fuldkornsbrød og korn indeholder mindre fedt, der producerer disse kræftfremkaldende stoffer og kan modvirke virkningerne af kræftfremkaldende stoffer. Begge virkninger ville hjælpe med at reducere risikoen for kræft.
Forskning har vist, at de fleste kolorektale kræftformer udvikler sig i kolorektale polypper. Derfor kan fjernelse af godartede (men præcancerøse) kolorektale polypper forhindre kolorektal cancer. Forstadier til kolorektale polypper kaldes oftest adenomatøse polypper. De udvikler sig, når der opstår kromosomskader i celler i tyktarmens indre foring. Skaden producerer unormale celler, men cellerne har endnu ikke udviklet evnen til at sprede sig, kendetegnet ved kræft. I stedet forbliver det voksende væv lokaliseret i polyppen. Når kromosomskader øges yderligere inde i polyppen, bliver cellevæksten ukontrolleret, og cellerne begynder at sprede sig, det vil sige, at de bliver til kræft. Således får tyktarmspolypper, som oprindeligt er godartede, yderligere kromosomskader og bliver kræft.
Kronisk colitis ulcerosa forårsager betændelse i tyktarmens indre foring. Tarmkræft er en anerkendt komplikation til kronisk colitis ulcerosa. Risikoen for kræft begynder at stige efter otte til 10 år med colitis. Risikoen for at udvikle tyktarmskræft hos en patient med colitis ulcerosa er også relateret til placeringen og omfanget af hans eller hendes sygdom.
Patienter med højere risiko for kræft er dem med en familiehistorie med tyktarmskræft, langvarig colitis ulcerosa, omfattende tyktarmspåvirkning med ulcerøs colitis og dem med ulcerøs colitis-associeret leversygdom, skleroserende cholangitis.
Da de kræftformer, der er forbundet med colitis ulcerosa, har et mere gunstigt resultat, når de fanges på et tidligere tidspunkt, anbefales årlige undersøgelser af tyktarmen ofte efter otte år med kendt omfattende sygdom. Under disse undersøgelser udtages prøver af væv (biopsier) for at søge efter præcancerøse forandringer i cellerne i tyktarmen. Når der konstateres præcancerøse ændringer, kan det være nødvendigt at fjerne hele tyktarmen for at forhindre tyktarmskræft.
En persons genetiske baggrund er en vigtig faktor i risikoen for tyktarmskræft. At have en førstegradsslægtning med tyktarmskræft, især hvis kræften blev diagnosticeret før 55 års alderen, fordobler groft sagt risikoen for at udvikle tilstanden.
Selvom en familiehistorie med tyktarmskræft er en vigtig risikofaktor, forekommer et flertal (80%) af tyktarmskræft sporadisk hos patienter uden familiehistorie med tyktarmskræft. Cirka 20 % af kræfttilfældene er forbundet med en familiehistorie med tyktarmskræft.
Kromosomer indeholder genetisk information, og kromosomskader forårsager genetiske defekter, der fører til dannelse af tyktarmspolypper og senere tyktarmskræft. Ved sporadiske polypper og kræftformer (polypper og kræftformer, der udvikler sig uden familiehistorie), erhverves kromosomskaderne (udvikles i en celle i voksenlivet). De beskadigede kromosomer kan kun findes i polypperne og de kræftformer, der udvikler sig fra den celle. Men ved arvelige tyktarmskræftsyndromer nedarves kromosomfejlene ved fødslen og findes i alle celler i kroppen. Patienter, der har arvet generne for arvelig tyktarmskræftsyndrom, er i risiko for at udvikle tyktarmspolypper, sædvanligvis i unge aldre, og har meget høj risiko for at udvikle tyktarmskræft tidligt i livet; de er også i risiko for at udvikle kræft i andre organer.
Familiær adenomatøs polypose (FAP) er et arveligt kolorektal cancersyndrom, hvor de berørte familiemedlemmer vil udvikle utallige antal (hundrede, nogle gange tusinder) af tyktarmspolypper, der starter i løbet af deres teenageår. Medmindre tilstanden opdages og behandles tidligt (behandling involverer fjernelse af tyktarmen), er en person, der er ramt af FAP, næsten sikker på at udvikle tyktarmskræft fra disse polypper. Kræft udvikler sig næsten helt sikkert, når en person er i 40'erne. Disse patienter er også i risiko for at udvikle andre kræftformer såsom kræft i skjoldbruskkirtlen, maven og ampulla (en del af galdekanalen, hvor den dræner ind i tyndtarmen fra leveren) samt godartede svulster kaldet desmoide tumorer. FAP opstår fra en mutation i et specifikt gen kaldet APC-genet. Den specifikke mutation kan identificeres hos de fleste mennesker med passende test, og en sådan test anbefales til personer med diagnosen FAP såvel som deres familiemedlemmer.
Svækket familiær adenomatøs polypose (AFAP) er en mildere version af FAP. Berørte medlemmer udvikler færre end 100 kolonpolypper. Ikke desto mindre har de stadig en meget høj risiko for at udvikle tyktarmskræft i en ung alder. De er også i risiko for at have gastriske polypper og duodenale polypper.
Arvelig non-polypose tyktarmskræft (også kendt som Lynch syndrom eller HNPCC) er et arveligt tyktarmskræftsyndrom, hvor berørte familiemedlemmer kan udvikle tyktarmspolypper og kræftformer, normalt i højre tyktarm, i 30'erne til 40'erne. Patienter med HNPCC er også i risiko for at udvikle livmoderkræft, mavekræft, kræft i æggestokkene og kræft i urinlederne (rørene, der forbinder nyrerne med blæren) og galdekanalerne. Ironisk nok ser det ud til, at selvom tyktarmskræft forekommer hyppigere hos patienter med HNPCC, kan disse kræftformer lettere helbredes end "sporadiske" tyktarmskræftformer. De specifikke genetiske abnormiteter forbundet med HNPCC er blevet identificeret, og patienter og familiemedlemmer kan testes for at afgøre, om HNPCC er til stede, og om familiemedlemmer bærer abnormiteten og sandsynligvis vil udvikle kræft.
MYH polypose syndrom er et nyligt opdaget arveligt kolorektal cancersyndrom. Berørte medlemmer udvikler typisk 10 til 100 polypper ved omkring 40 års alderen og har høj risiko for at udvikle tyktarmskræft. Også her er den genetiske abnormitet blevet identificeret.
Det er vigtigt at huske, at det overvældende flertal af tyktarmskræft ikke har en enkelt, identificerbar kromosomafvigelse, som man kan lede efter hos slægtninge for at identificere individer med risiko for tyktarmskræft.
Kolorektal cancer-relaterede symptomer er talrige og uspecifikke. De omfatter træthed, svaghed, åndenød, ændring i afføringsvaner, smal afføring, diarré eller forstoppelse, rødt eller mørkt blod i afføringen, vægttab, mavesmerter, kramper eller oppustethed. Andre tilstande såsom irritabel tyktarm (spastisk tyktarm), colitis ulcerosa, Crohns sygdom, divertikulose og mavesår kan have symptomer, der efterligner tarmkræft.
Kolorektal cancer kan være til stede i flere år, før symptomerne udvikler sig. Symptomerne varierer alt efter, hvor i tyktarmen tumoren er placeret. Den højre kolon er bredere og mere fleksibel. Det kan endda kaldes relativt rummeligt sammenlignet med resten af tyktarmen. Kræft i højre tyktarm kan vokse til store størrelser, før de forårsager abdominale symptomer. Typisk forårsager højresidige kræftformer jernmangelanæmi på grund af det langsomme tab af blod over en længere periode. Jernmangelanæmi forårsager træthed, svaghed og åndenød. Venstre tyktarm er smallere end højre tyktarm. Derfor er kræft i venstre tyktarm mere tilbøjelige til at forårsage delvis eller fuldstændig tarmobstruktion. Kræft, der forårsager delvis tarmobstruktion, kan forårsage symptomer på forstoppelse, indsnævret afføring, diarré, mavesmerter, kramper og oppustethed. Lyst rødt blod i afføringen kan også indikere en vækst nær enden af venstre tyktarm eller endetarm.
Når der er mistanke om tyktarmskræft, udføres en koloskopi typisk for at bekræfte diagnosen og lokalisere tumoren.
Koloskopi er en procedure, hvor en sundhedspersonale indsætter et langt, fleksibelt synsrør i endetarmen med det formål at inspicere indersiden af hele tyktarmen. Koloskopi anses generelt for at være mere nøjagtig end røntgenstråler af bariumlavement, især ved påvisning af små polypper. Hvis der findes kolonpolypper, fjernes de normalt gennem koloskopet og sendes til patologen. Patologen undersøger polypperne under mikroskopet for at tjekke for kræft. Koloskopi er den bedste procedure at bruge, når der er mistanke om kræft i tyktarmen. Mens størstedelen af polypperne, der fjernes gennem koloskoper, er godartede, er mange præcancerøse. Fjernelse af præcancerøse polypper forhindrer den fremtidige udvikling af tyktarmskræft fra disse polypper.
Sigmoidoskopi er en procedure, der udføres ved hjælp af et kortere fleksibelt omfang til kun at undersøge venstre tyktarm og endetarm. Det er nemmere at forberede og udføre end en komplet koloskopi, men har åbenlyse begrænsninger i forhold til ikke at være lang nok til at vurdere både højre og tværgående tyktarm. Polypfjernelse og cancerbiopsi kan udføres gennem sigmoidoskopet.
Hvis der konstateres kræftvækst under koloskopi, kan små vævsprøver (biopsier) tages og undersøges under mikroskop for at afgøre, om polyppen er kræft. Hvis tyktarmskræft bekræftes ved en biopsi, udføres stadieundersøgelser for at afgøre, om kræften allerede har spredt sig til andre organer. Da tyktarmskræft har en tendens til at sprede sig til lungerne og leveren, omfatter iscenesættelsestest normalt CT-scanninger af lunger, lever og mave. Positron-emissionstomografi (PET)-scanninger, en nyere test, som leder efter den øgede metaboliske aktivitet, der er almindelig i kræftvæv, bruges også ofte til at lede efter spredning af tyktarmskræft til lymfeknuder eller andre organer.
Nogle gange kan sundhedspersonalet få en "tumormarkør"-blodprøve kaldet et carcinoembryonalt antigen (CEA), hvis der er mistanke om kræft. CEA er et stof, der produceres af nogle tyktarms- og endetarmskræftceller såvel som af nogle andre typer kræft. Det findes nogle gange i høje niveauer hos patienter med tyktarmskræft, især når sygdommen har spredt sig. Det kan tjene som en nyttig test at følge, hvis det viser sig at være forhøjet, før kræften fjernes. Det er dog ikke alle patienter med tyktarmskræft, der vil have en forhøjet CEA, selvom deres kræft har spredt sig. (Nogle kolorektale kræftformer producerer det ikke.) Derudover er nogle patienter uden kræft kan have en forhøjet CEA-blodprøve. Omkring 15 % af rygerne vil for eksempel have en forhøjet CEA uden tyktarmskræft. Så CEA bruges ikke til at diagnosticere kolorektal cancer, men snarere til at følge virkningerne af behandling af kolorektal cancer hos en person med en kendt historie om sygdommen, fordi igen hos nogle patienter er mængden af kræftvæv korreleret med niveauet af CEA.
Når kolorektal cancer er diagnosticeret, udføres yderligere tests for at bestemme omfanget af sygdommen. Denne proces kaldes iscenesættelse. Iscenesættelse afgør, hvor fremskreden tyktarmskræft er blevet. Stadieinddelingen for tyktarmskræft spænder fra stadium I, den mindst fremskredne cancer, til stadium IV, den mest fremskredne cancer.
Med hvert efterfølgende stadium af tyktarmskræft stiger risikoen for tilbagevendende kræft og død som følge af spredning af kræft (metastaser). Som nævnt har tidligere kræftformer lavere risiko for tilbagefald og død. På det tidspunkt, hvor en person har stadium IV kolorektal cancer, er prognosen dårlig. Men selv i stadium IV kolorektal cancer (afhængigt af hvor kræften har spredt sig) er der mulighed for en helbredelse.
Kirurgi er den mest almindelige indledende medicinske behandling for tyktarmskræft. Under operationen fjernes tumoren, en lille margin af den omgivende sunde tarm og tilstødende lymfeknuder. Kirurgen forbinder derefter de sunde dele af tarmen igen. Hos patienter med endetarmskræft fjernes endetarmen nogle gange permanent, hvis kræften opstår for lavt i endetarmen. Kirurgen skaber derefter en åbning (kolostomi) på bugvæggen, hvorigennem fast affald fra tyktarmen udskilles. Specielt uddannede sygeplejersker (enterostomale terapeuter) kan hjælpe patienter med at tilpasse sig kolostomier, og de fleste patienter med kolostomi vender tilbage til en normal livsstil.
For tidlige tarmkræftformer er den anbefalede behandling kirurgisk fjernelse. For de fleste mennesker med tidligt stadium tyktarmskræft (stadie I og de fleste stadium II), er kirurgi alene den eneste behandling, der kræves. Kemoterapi kan tilbydes til nogle mennesker med stadium II-kræft, som har faktorer, der tyder på, at deres tumor kan have højere risiko for tilbagefald. Men når tyktarmskræft har spredt sig til lokale lymfeknuder (stadium III), er risikoen for, at kræften vender tilbage, fortsat høj, selvom alle synlige tegn på kræften er blevet fjernet af kirurgen. Dette skyldes en øget sandsynlighed for, at små kræftceller kan være undsluppet før operationen og er for små til at opdage på det tidspunkt ved blodprøver, scanninger eller endda direkte undersøgelse. Deres tilstedeværelse udledes af en højere risiko for tilbagefald af tyktarmskræften på et senere tidspunkt (tilbagefald). Medicinske kræftlæger (medicinske onkologer) anbefaler yderligere tyktarmskræftbehandlinger med kemoterapi i denne indstilling for at mindske risikoen for, at kræften vender tilbage. Lægemidler, der bruges til kemoterapi, trænger ind i blodbanen og angriber tyktarmskræftceller, der blev udgydt i blodet eller lymfesystemet før operationen, og forsøger at dræbe dem, før de etablerer butik i andre organer. Denne strategi, kaldet adjuverende kemoterapi, har vist sig at sænke risikoen for tilbagefald af kræft og anbefales til alle patienter med stadium III tyktarmskræft, som er raske nok til at gennemgå det, såvel som til nogle højere risiko stadium II patienter, hvis tumor kan have vist sig at have blokeret eller perforeret tarmvæggen før operationen.
Der er flere forskellige muligheder for adjuverende kemoterapi til behandling af tyktarmskræft. Behandlingerne involverer en kombination af kemoterapimedicin givet oralt eller i venerne. Behandlingerne gives typisk i i alt seks måneder. Det er vigtigt at mødes med en onkolog, som kan forklare mulighederne for adjuverende kemoterapi samt bivirkninger, man skal være opmærksom på, så det rigtige valg kan træffes for en patient som individ.
Kemoterapi gives normalt på en sundhedspersonalets klinik, på hospitalet som ambulant eller i hjemmet. Kemoterapi gives normalt i behandlingscyklusser efterfulgt af restitutionsperioder uden behandling. Bivirkninger af kemoterapi varierer fra person til person og afhænger også af de midler, der gives. Moderne kemoterapimidler tolereres normalt godt, og bivirkninger for de fleste mennesker er overkommelige. Generelt ødelægger medicin mod kræft celler, der hurtigt vokser og deler sig. Derfor kan normale røde blodlegemer, blodplader og hvide blodlegemer, der også vokser hurtigt, blive påvirket af kemoterapi. Som følge heraf omfatter almindelige bivirkninger anæmi, energitab og lav modstand mod infektioner. Celler i hårrødderne og tarmene deler sig også hurtigt. Derfor kan kemoterapi forårsage hårtab, mundsår, kvalme, opkastning og diarré, men disse virkninger er forbigående.
Når kolorektal cancer har spredt sig fjernt fra det primære tumorsted, beskrives det som stadium IV sygdom. Disse fjerne tumoraflejringer, der er afgivet fra den primære tumor, har rejst gennem blodet eller lymfesystemet og danner nye tumorer i andre organer. På det tidspunkt er kolorektal cancer ikke længere et lokalt problem, men er i stedet et systemisk problem med kræftceller, der både er synlige på scanning og ikke kan påvises, men sandsynligvis til stede andre steder i kroppen. Som følge heraf er den bedste behandling i de fleste tilfælde kemoterapi, som er systemisk terapi. Kemoterapi ved metastatisk kolorektal cancer har vist sig at forlænge levetiden og forbedre livskvaliteten. Hvis det håndteres godt, er bivirkningerne af kemoterapi typisk langt mindre end bivirkningerne ved ukontrolleret cancer. Kemoterapi alene kan ikke helbrede metastatisk tyktarmskræft, men den kan mere end fordoble den forventede levetid og give mulighed for god livskvalitet i behandlingstiden.
Kemoterapi muligheder for kolorektal cancerbehandling varierer afhængigt af andre sundhedsproblemer, som en person står over for. For raskere personer anbefales kombinationer af flere kemoterapeutiske lægemidler sædvanligvis, hvorimod enklere behandlinger kan være bedst til mere syge mennesker. Forskellige multidrug-regimer kombinerer midler med dokumenteret aktivitet i tyktarmskræft såsom 5-fluorouracil (5-FU), som ofte gives sammen med lægemidlet leucovorin (også kaldet folinsyre) eller et lignende lægemiddel kaldet levoleucovorin, som hjælper det med at fungere bedre.
Capecitabine (Xeloda), er et kemoterapipræparat givet i pilleform. Når den først er i kroppen, ændres den til 5-FU, når den kommer til tumorstedet. Andre kemoterapipræparater til tyktarmskræft er irinotecan (Camptosar), oxaliplatin (Eloxatin) og trifluridin og tipiracil (Lonsurf), et kombinationslægemiddel i pilleform. Kemoterapiregimer har ofte akronymer for at forenkle deres nomenklatur (såsom FOLFOX, FOLFIRI og FLOX).
Targeted therapies are newer treatments that target specific aspects of the cancer cell, which may be more important to the tumor than the surrounding tissues, offering potentially effective treatments with fewer side effects than traditional chemotherapy. Bevacizumab (Avastin), cetuximab (Erbitux), panitumumab (Vectibix), ramucirumab (Cyramza), regorafenib (Stivarga), and ziv-aflibercept (Zaltrap) are targeted therapies that have been used in the management of advanced colorectal cancer. These newer chemotherapeutic agents most often are combined with standard chemotherapy to enhance their effectiveness.
If the first treatment is not effective, second- and third-line options are available that can confer a benefit to people living with colorectal cancer.
Radiation therapy is the primary treatment of colorectal cancer has been limited to treating cancer of the rectum. As noted earlier, whereas parts of the colon move freely within the abdominal cavity, the rectum is fixed in place within the pelvis. It is in an intimate relationship with many other structures and the pelvis is a more confined space. For these reasons, a tumor in the rectum often is harder to remove surgically because space is smaller and other structures can be involved with cancer. As a result, for all but the earliest rectal cancers, initial chemotherapy and radiation treatments (a local treatment to a defined area) are recommended to try and shrink cancer, allowing for easier removal and lowering the risk of cancer returning locally. Radiation therapy is typically given under the guidance of a radiation specialist called a radiation oncologist. Initially, individuals undergo a planning session, a complicated visit as the doctors and technicians determine exactly where to give the radiation and which structures to avoid. Chemotherapy usually is administered daily while the radiation is delivered. Side effects of radiation treatment include fatigue, temporary or permanent pelvic hair loss, and skin irritation in the treated areas.
Radiation therapy will occasionally be used as a palliative treatment to reduce pain from the recurrent or metastatic colon or rectal cancer.
Follow-up exams are important for people with colorectal cancer. The cancer can come back near the original site, although this is unusual. If the cancer returns, it typically does so in a distant location such as the lymph nodes, liver, or lungs. Individuals diagnosed with colorectal cancer remain at risk of their cancer returning for up to 10 years after their original diagnosis and treatment, although the risk of recurrence is much higher in the first few years. Medical providers in the United States follow patients with physical examinations and blood tests including the CEA (if it was elevated before surgery) tumor marker every three months for the first two years and then with decreasing frequency thereafter. Patients are also followed with colonoscopies (starting one year after their diagnosis) and with CT scans (typically performed at least once yearly for the first two to five years).
If a recurrence is noted either locally or with metastatic spread, individuals may still be treated with the intention of cure. For example, if a new tumor were to recur in the liver, individuals can be treated with a combination of chemotherapy and surgery (or sophisticated radiation techniques) in hopes of eradicating the cancer completely. Evaluation in hospitals of excellence that specialize in liver surgery can help guide these complicated treatment decisions and increase the chances of cure even in the setting of metastatic disease.
In addition to checking for cancer recurrence, patients who have had bowel cancer may have an increased risk of cancer of the prostate, breast, and ovary. Therefore, follow-up examinations in the clinic should include cancer screening for these diseases, as well.
Colorectal cancers are typically slow-growing cancers that take years to develop. Because they grow most often in a step-wise manner, screening can greatly reduce the likelihood of death associated with the disease. Whether with virtual colonoscopy or newer screening techniques, the future must focus first and foremost on better, more comprehensive screening programs that find polyps and early cancers before they become life-threatening. The public also must be educated on the value of screening programs.
For those living with cancer, intensive research is ongoing to better understand cancer biology and genetics so that specific approaches can be developed to attack specific types of cancers and, more importantly, specific individuals' cancers. Each person living with cancer has a disease with a unique biology and genetic code and the secret to better treatments involves unlocking that code. Cancer is very complex and scientists are just beginning to unravel its secrets. Progress is frustratingly slow for those battling the disease. With each passing year, however, our understanding increases and treatments become more refined. If you or your family member is living with colorectal cancer, speak with your doctor about ways you can participate in research through clinical trials to help increase our knowledge and improve our therapies for this difficult disease.
Survival rates for any cancer are often reported by stage, the extent of spread when the cancer is identified. For colon and rectum cancer, around 39% are diagnosed at the local stage, before the cancer has spread outside the local area. The five-year survival for these patients with localized colon and rectum cancer is around 90%.
When the cancer has spread to the regional lymph nodes near the site of origin, the five-year survival rate is about 71%. When the cancer has metastasized to distant sites in the body (stage IV cancer), the five-year survival rate lowers to about 14%.
The most effective prevention for colorectal cancer is early detection and removal of precancerous colorectal polyps before they turn cancerous. Even in cases where cancer has already developed, early detection still significantly improves the chances of a cure by surgically removing the cancer before the disease spreads to other organs.
Regular physical activity is associated with lower risk of colon cancer. Aspirin use also appears to lower the risk of bowel cancer. The use of combined estrogen and progestin in hormone replacement therapy lowers the risk of colon cancer in postmenopausal women. Hormone replacement therapy has risks which must be weighed against this effect, and should be discussed with a doctor.
Blood tests are now available to test for hereditary colon cancer syndromes. Families with multiple members having colon cancers, multiple colon polyps, cancers at young ages, and other cancers such as cancers of the ureters, uterus, duodenum, and more, may take advantage of resources such as genetic counseling, followed possibly by genetic testing. Genetic testing without prior counseling is discouraged because of the extensive family education that is involved and the complicated nature of interpreting the test results.
The advantages of genetic counseling followed by genetic testing include:(1) identifying family members at high risk of developing colon cancer to begin colonoscopies early; (2) identifying high-risk members so that screening may begin to prevent other cancers such as ultrasound tests for uterine cancer, urine examinations for ureter cancer, and upper endoscopies for stomach and duodenal cancers; and (3) alleviating concern for members who test negative for the hereditary genetic defects.
People can change their eating habits by reducing fat intake and increasing fiber (roughage) in their diet. Major sources of fat are meat, eggs, dairy products, salad dressings, and oils used in cooking. Fiber is the insoluble, nondigestible part of plant material present in fruits, vegetables, and whole-grain breads and cereals. It is postulated that high fiber in the diet leads to the creation of bulky stools which can rid the intestines of potential carcinogens. In addition, fiber leads to the more rapid transit of fecal material through the intestine, thus allowing less time for a potential carcinogen to react with the intestinal lining.
The term "screening" is properly applied only to the use of testing to look for evidence of cancer or pre-cancerous polyps in individuals who are asymptomatic and at only average risk for a type of cancer. Those patients who, for example, have a positive family history of colon cancer, or are symptomatic for a colon abnormality, undergo diagnostic testing rather than screening tests.
There are different types of screening tests for colorectal cancer:fecal (stool) occult blood testing, sigmoidoscopy, colonoscopy, digital colonoscopy, and DNA testing of the stool. The US Preventive Services Task Force (USPSTF) recommends strongly that screening begin at age 50 years for average-risk adults, but there is no specific recommendation for one screening test or strategy over another. The USPSTF advises that patients be offered a choice of screening options, using shared decision-making with the patient and physician to arrive at the best choice of screening programs for each individual.
Tumors of the colon and rectum tend to bleed slowly into the stool. The small amount of blood mixed into the stool usually is not visible to the naked eye. The commonly used stool occult blood tests rely on chemical color conversions to detect microscopic amounts of blood. These tests are both convenient and inexpensive. There are two kinds of fecal occult blood tests. The first is known as a guaiac FOBT. In this test, a small amount of stool is smeared on a special card for occult blood testing when a chemical is added to the card. Usually, three consecutive stool cards are collected. The other type of FOBT is an immunochemical test in which a special solution is added to the stool sample and analyzed in the laboratory using antibodies that can detect blood in a stool sample. The immunochemical test is a quantitative test that is more sensitive and specific for the diagnosis of polyps and cancer. It is preferred over the guaiac test.
A person who tests positive for stool occult blood has a 30%-45% chance of having a colon polyp and a 3%-5% chance of having a colon cancer. Colon cancers found under these circumstances tend to be small and not to have spread and have a better long-term prognosis.
It is important to remember that having stool tested positive for occult blood does not necessarily mean a person has colon cancer. Many other conditions can cause occult blood in the stool. However, patients with a positive stool occult blood test should undergo further evaluations to exclude colon cancer and to explain the source of the bleeding. It is also important to realize that stool that has tested negative for occult blood does not mean that colorectal cancer or polyps do not exist. Even under ideal testing conditions, a significant percentage of colon cancers can be missed by stool occult blood screening. Many patients with colon polyps do not have positive stool occult blood. In patients suspected of having colorectal polyps and in those at higher risk for developing colorectal polyps and cancer, screening flexible sigmoidoscopies or colonoscopies are performed even if the FOBT is negative.
Flexible sigmoidoscopy is an exam of the rectum and the lower colon (60 cm or about 2 feet in from the outside) using a viewing tube (a short version of colonoscopy). Research studies have shown that the use of screening flexible sigmoidoscopy can reduce mortality from colon cancer. This is a result of the detection of polyps or early cancers in people with no symptoms. If a polyp or cancer is found, a complete colonoscopy is recommended. The majority of colon polyps can be completely removed at the time of colonoscopy without surgery; however, polyps in the proximal colon that cannot be reached by the sigmoidoscope will be missed. Flexible sigmoidoscopy is often combined with fecal occult blood testing for colorectal cancer screening.
Colonoscopy uses a long (120 cm-150 cm) flexible tube, which can examine the entire length of the colon. Through this tube, the doctor (typically a gastroenterologist) can both view and take pictures of the entire colon and also can take biopsies of colon masses and remove polyps.
Patients with a high risk of developing colorectal cancer may undergo screening colonoscopies starting at earlier ages than 50. For example, patients with a family history of colon cancer are recommended to start screening colonoscopies at an age 10 years before the earliest colon cancer diagnosed in a first-degree relative or five years earlier than the earliest precancerous colon polyp discovered in a first-degree relative. Patients with hereditary colon cancer syndromes such as FAP, AFAP, HNPCC, and MYH are recommended to begin colonoscopies early. The recommendations differ depending on the genetic defect. For example, in people with FAP, colonoscopies may begin during teenage years to look for the development of colon polyps. Patients with a prior history of polyps or colon cancer may also undergo colonoscopies to exclude recurrence. Patients with a long history (greater than 10 years) of chronic ulcerative colitis have an increased risk of colon cancer and should have regular colonoscopies to look for precancerous changes in the colon lining.
Virtual colonoscopy (computerized tomographic or CT colonography) has been utilized in the clinic as a screening technique for colorectal cancer. Virtual colonoscopy employs a CT scan using low doses of radiation with special software to visualize the inside of the colon and look for polyps or masses. The procedure typically involves a bowel preparation with laxatives and/or enemas (although not always) followed by a CT scan after air is introduced into the colon. Because no sedation is necessary, individuals can return to work or other activities upon completion of the test. Virtual colonoscopies appear to be equally able to detect larger polyps (over 1 centimeter in size) as regular colonoscopies. The virtual colonoscopy cannot be used to biopsy or remove tissue from the colon. A follow-up sigmoidoscopy or colonoscopy must be done to accomplish that.
The Cologuard test is available in the U.S. for in-home sample collection for adults over 50 at average risk for colon cancer. The sample is sent to a laboratory for analysis of DNA changes in DNA from cells shed by the intestinal lining into the stool or hemoglobin in the sample. In a research study, the test was able to find 92% of colon cancers and 69% of precancers of the colon. False-negative and false-positive results are also possible.
 LavFODMAP-diæt til IBS:Liste over fødevarer, der skal spises og undgås
FODMAP-fødevarer til IBS, definition og fakta En lav FODMAP kostplan kan hjælpe med at lindre IBS-symptomer. FODMAP står for F ermenterbar O ligosaccharider, D isaccharider, M onosaccharider og P oly
LavFODMAP-diæt til IBS:Liste over fødevarer, der skal spises og undgås
FODMAP-fødevarer til IBS, definition og fakta En lav FODMAP kostplan kan hjælpe med at lindre IBS-symptomer. FODMAP står for F ermenterbar O ligosaccharider, D isaccharider, M onosaccharider og P oly
 Stress og fordøjelse – 3 tips til at håndtere stress for at forbedre fordøjelsen
Jeg tænker ikke så ofte på den nat, hvor min far døde... det gør stadig for ondt. Han fik et massivt hjerteanfald en kold nat i december 2007... Og det var mig, der fandt ham. Han var allerede væk.
Stress og fordøjelse – 3 tips til at håndtere stress for at forbedre fordøjelsen
Jeg tænker ikke så ofte på den nat, hvor min far døde... det gør stadig for ondt. Han fik et massivt hjerteanfald en kold nat i december 2007... Og det var mig, der fandt ham. Han var allerede væk.
 Cøliaki
Definition og fakta om cøliaki Cøliaki er en fordøjelsesintolerance over for gluten, som er et almindeligt protein, der findes i brød og andre hvedeprodukter. Symptomerne involverer normalt fordøje
Cøliaki
Definition og fakta om cøliaki Cøliaki er en fordøjelsesintolerance over for gluten, som er et almindeligt protein, der findes i brød og andre hvedeprodukter. Symptomerne involverer normalt fordøje