 Paksusuolisyöpä on kolmanneksi yleisin syövän aiheuttaja Yhdysvalloissa.
Paksusuolisyöpä on kolmanneksi yleisin syövän aiheuttaja Yhdysvalloissa.Paksusuolisyövän merkit ja oireet eivät yleensä ole spesifisiä. Toisin sanoen merkit ja oireet voivat ilmetä useiden eri olosuhteiden vuoksi. Kun paksusuolen syöpä havaitaan varhaisessa vaiheessa, se ei ehkä ole edes aiheuttanut oireita. Oireet voivat myös vaihdella sen mukaan, missä paksusuolessa kasvain sijaitsee.
Joitakin paksusuolensyövän oireita ja merkkejä ovat:

Joka päivä kehossamme tapahtuu valtava tuhoutumis- ja korjausprosessi. Ihmiskeho koostuu noin 15 biljoonasta soluja ja joka päivä miljardeja soluista kuluvat tai tuhoutuvat. Useimmissa tapauksissa joka kerta kun solu tuhoutuu, keho tekee uuden solun korvaamaan sen, yrittäen tehdä solun, joka on täydellinen kopio tuhoutuneesta solusta, koska korvaavan solun on kyettävä suorittamaan sama tehtävä kuin tuhoutunut solu. Monimutkaisen solujen vaihtoprosessin aikana tapahtuu monia virheitä. Huolimatta erittäin tyylikkäistä virheiden ehkäisyjärjestelmistä, runko tekee silti kymmeniä tuhansia virheitä päivittäin vaihtaessaan soluja joko satunnaisten virheiden vuoksi tai siksi, että korvausprosessiin kohdistuu ulkoisia paineita, jotka edistävät virheitä. Suurin osa näistä virheistä korjataan uusilla tyylikkäillä järjestelmillä tai virhe johtaa juuri tehdyn solun kuolemaan ja syntyy toinen normaali uusi solu. Joskus kuitenkin tehdään virhe, jota ei korjata. Monilla korjaamattomilla virheillä on vain vähän vaikutusta terveyteen, mutta jos virhe sallii juuri tehdyn solun jakautumisen riippumatta normaalia solukasvua säätelevistä säännöistä ja tasapainoista, solu voi alkaa lisääntyä hallitsemattomasti. Kun näin tapahtuu, kasvain (lähinnä epänormaalien solujen massa) voi kehittyä.
Kasvaimet jaetaan kahteen luokkaan:on hyvänlaatuisia (ei-syöpäisiä) kasvaimia ja pahanlaatuisia (syöpäkasvaimia). Joten mikä ero on? Vastaus on, että hyvänlaatuinen kasvain kasvaa vain kudoksessa, josta se syntyy. Hyvänlaatuiset kasvaimet voivat joskus kasvaa melko suuriksi tai nopeasti ja aiheuttaa vakavia oireita, jopa kuoleman, vaikka useimmat eivät. Esimerkiksi fibroidikasvain naisen kohdussa on eräänlainen hyvänlaatuinen kasvain. Se voi aiheuttaa verenvuotoa tai kipua, mutta se ei koskaan kulje kohdun ulkopuolelle ja kasvaa uutena kasvaimena muualla. Fibroidit, kuten kaikki hyvänlaatuiset kasvaimet, eivät pysty erittämään soluja vereen ja imusuonijärjestelmään, joten ne eivät voi matkustaa muihin paikkoihin kehossa ja kasvaa. Syöpä puolestaan voi irrottaa soluja, jotka voivat kulkea veren tai imukudoksen läpi, laskeutua kudoksiin, jotka ovat kaukana primäärikasvaimesta, ja kasvaa uusiksi kasvaimiksi näissä kaukaisissa kudoksissa. Tämä kaukaisiin kudoksiin leviämisprosessi, jota kutsutaan etäpesäkkeeksi, on syövän tai pahanlaatuisen kasvaimen määrittelevä ominaisuus.
Hyvänlaatuiset kasvainsolut näyttävät usein suhteellisen normaaleilta, kun niitä tutkitaan mikroskoopilla. Pahanlaatuiset tai syöpäsolut näyttävät yleensä epänormaalimmilta, kun niitä tarkastellaan samalla tavalla mikroskoopin alla.
Syöpä on ryhmä yli 100 eri tautia, aivan kuten tartuntataudit. Syövät nimetään niiden kudosten mukaan, joista ensimmäinen kasvain syntyy. Näin ollen maksaan kulkeutuva keuhkosyöpä ei ole maksasyöpä, vaan sitä kuvataan maksassa metastaattiseksi keuhkosyöväksi, ja aivoihin leviävää rintasyöpää ei kuvata aivokasvaimeksi vaan pikemminkin rintasyöväksi, joka on metastaattinen maksassa. aivot. Jokainen syöpä on erilainen sairaus, jolla on erilaiset hoitovaihtoehdot ja vaihtelevat ennusteet (todennäköiset tulokset tai elinajanodote). Itse asiassa jokaisella syöpää sairastavalla yksilöllä on ainutlaatuinen sairaus, ja hoidon suhteellinen onnistuminen tai puute saman diagnoosin saaneiden potilaiden kesken voi olla hyvinkin erilainen. Tästä syystä on tärkeää, että jokaista syöpädiagnoosista kärsivää kohdellaan yksilönä syövän tyypistä riippumatta.
 Kuva paksusuolen syövästä.
Kuva paksusuolen syövästä.
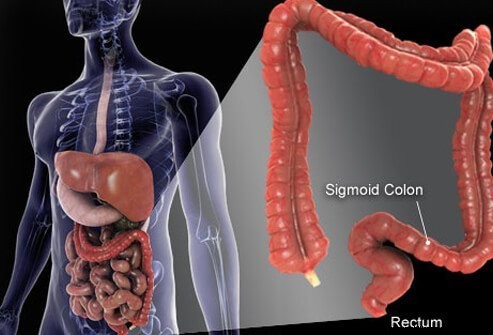
Paksusuoli ja peräsuole ovat putken viimeiset osat, joka ulottuu suusta peräaukkoon. Ruoka joutuu suuhun, jossa se pureskellaan ja sitten niellään. Sitten se kulkee ruokatorven läpi mahalaukkuun. Vatsassa ruoka jauhetaan pienemmiksi hiukkasiksi ja menee sitten ohutsuoleen tarkasti kontrolloidusti. Ohutsuolessa tapahtuu ruoan lopullinen sulaminen ja ruoan sisältämien ravintoaineiden imeytyminen. Ruoka, joka ei sula ja imeydy, joutuu paksusuoleen (koolon) ja lopulta peräsuoleen. Paksusuoli toimii ensisijaisesti jätteiden varastona; ylimääräinen vesi, suolat ja jotkut vitamiinit poistetaan kuitenkin edelleen. Lisäksi osa sulamattomasta ruoasta, esimerkiksi kuitu, sulautuu paksusuolen bakteerien toimesta ja osa ruoansulatustuotteista imeytyy paksusuolesta elimistöön. (Arviolta 10 % ruoasta saadusta energiasta tulee näistä paksusuolen bakteerien ruoansulatustuotteista.) Jäljelle jäänyt sulamaton ruoka, kuolevat solut suoliston limakalvosta ja suuri määrä bakteereja varastoituu paksusuoleen ja sitten siirtyi ajoittain peräsuoleen. Niiden saapuminen peräsuoleen käynnistää suolen liikkeen, joka tyhjentää paksusuolen sisällön kehosta ulosteena.
Vaikka paksusuoli on putki, se on rakenteellisesti monimutkainen putki, enemmänkin teräshihnarengas kuin puutarhaletku. Putki koostuu neljästä kerroksesta. Ensimmäinen on limakalvoksi kutsuttu sisäkerros soluja, jotka reunustavat onteloa, jonka läpi sulamaton ja sulava ruoka kulkee. Limakalvo on kiinnittynyt ohueen toiseen kerrokseen, submucosaan, joka on kiinnittynyt lihaskerrokseen, muscularis. Koko putkea ympäröi kuitumainen (arpien kaltainen) kudos, jota kutsutaan serosaksi. Yleisimmät paksusuolen syövät (tyyppi nimeltä adenokarsinooma) syntyvät limakalvosta, solujen sisäkerroksesta. Nämä solut altistuvat ruoan ja bakteerien myrkkyille sekä mekaaniselle kulumiselle, ja ne muuttuvat suhteellisen nopeasti (kuolevat pois ja korvautuvat). Virheet (yleensä sarja virheitä, jotka liittyvät korvaussolujen geeneihin) johtavat epänormaaleihin soluihin ja syöpää aiheuttavien epänormaalien solujen hallitsemattomaan lisääntymiseen. Nopea vaihtuvuus mahdollistaa enemmän virheitä verrattuna kudoksiin, jotka eivät käänny niin nopeasti (esimerkiksi maksakudos).
Suurin osa paksusuolesta lepää vatsan ontelossa, jota kutsutaan vatsaonteloksi. Paksusuolen osat voivat liikkua melko vapaasti vatsaontelossa, kun sulamaton ruoka kulkee sen läpi. Kun paksusuolen suuntautuu kohti peräsuolea, se kiinnittyy vatsaontelon takana oleviin kudoksiin, alue, jota kutsutaan retroperitoneumiksi. Paksusuolen päätyosa, retroperitoneumissa sijaitseva osa, on peräsuole. Toisin kuin suuri osa muusta paksusuolen osasta, peräsuolen kiinnittyvät paikalleen sitä ympäröivät kudokset. Sijainnistaan johtuen peräsuolen syövän hoito on usein erilaista kuin muun paksusuolen syövän hoito.
 Kuva paksusuolen poikkileikkauksesta.
Kuva paksusuolen poikkileikkauksesta. 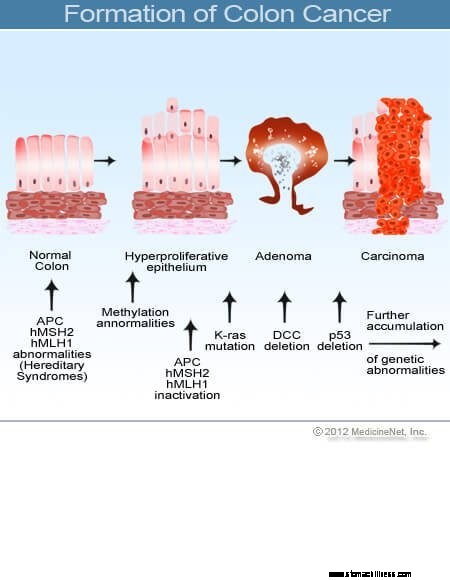 Kuva paksusuolen syövän muodostumisesta.
Kuva paksusuolen syövän muodostumisesta.
Ihmisen paksusuoli (paksusuoli) on noin 6 jalkaa pitkä.
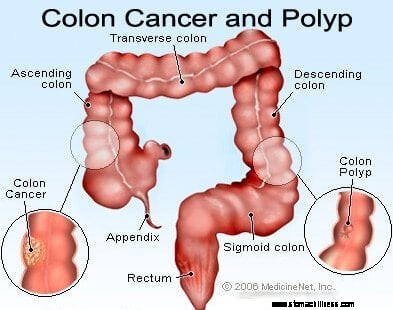
Paksusuolen ja peräsuolen syövät (kolorektaalisyöpä) alkavat, kun paksusuolen limakalvosolujen normaali korvaaminen menee pieleen. Virheitä solun jakautumisessa tapahtuu usein. Syistä, jotka ovat huonosti ymmärretty, joskus tapahtuu virheitä, jotka jäävät muokkausjärjestelmiemme ulkopuolelle. Kun näin tapahtuu, nämä solut alkavat jakautua riippumatta normaalista kasvua säätelevistä tasapainoista. Kun nämä epänormaalit solut kasvavat ja jakautuvat, ne voivat johtaa paksusuolen kasvuun, jota kutsutaan polyypeiksi. Polyypit vaihtelevat tyypiltään, mutta monet ovat esisyöpäkasvaimia, jotka kasvavat hitaasti vuosien kuluessa eivätkä leviä. Kun polyypit kasvavat, geneettiset lisämutaatiot lisäävät solujen vakautta. Kun nämä esisyöpäkasvaimet muuttavat suuntaa (kasvavat putken seinämään sen keskellä olevaan tilaan) ja tunkeutuvat paksusuolen muihin kerroksiin (kuten submukoosiin tai lihaskerrokseen), esisyövän polyypistä on tullut syöpä. Useimmissa tapauksissa tämä prosessi on hidasta, ja kestää vähintään 8-10 vuotta kehittyä noista varhaisista poikkeavista soluista suoraan syöpään. Kolorektaalisyöpä on tyypillisesti adenokarsinooma, termi, joka viittaa syöpään, joka on muodostunut tietyntyyppisiin kehon limakalvokudoksiin.
Kun paksusuolen syöpä muodostuu, se alkaa kasvaa kahdella tavalla. Ensinnäkin syöpä voi kasvaa paikallisesti ja ulottua suolen seinämän läpi ja tunkeutua viereisiin rakenteisiin, mikä tekee massasta (kutsutaan ensisijaiseksi kasvaimeksi) enemmän ongelmaa ja vaikeampaa poistaa. Paikallinen laajennus voi aiheuttaa lisäoireita, kuten kipua tai täyteläisyyttä, paksusuolen perforaatiota tai paksusuolen tai lähellä olevien rakenteiden tukkeumia. Toiseksi, kun syöpä kasvaa, se aloittaa etäpesäkkeiden muodostumisprosessin ja vuotaa tuhansia soluja päivässä vereen ja imunestejärjestelmään, mikä voi aiheuttaa syöpien muodostumista kaukaisiin paikkoihin. Kolorektaalisyövät leviävät yleisimmin ensin paikallisiin imusolmukkeisiin ennen matkaamista kaukaisiin elimiin. Kun paikalliset imusolmukkeet ovat mukana, leviäminen maksaan, vatsaonteloon ja keuhkoihin ovat seuraavaksi yleisimmät metastaattisen leviämisen kohteet.
Kolorektaalisyöpä on kolmanneksi yleisin syövän aiheuttaja Yhdysvalloissa sekä miehillä että naisilla. Se vaikuttaa yli 135 000 ihmiseen vuosittain, mikä on 8 % kaikista syövistä. Noin 4,3 prosentilla ihmisistä diagnosoidaan paksu- tai peräsuolen syöpä jossain vaiheessa elämäänsä.
Napsauttamalla "Lähetä" hyväksyn MedicineNetin käyttöehdot ja tietosuojakäytännön. Hyväksyn myös sähköpostien vastaanottamisen MedicineNetiltä ja ymmärrän, että voin kieltäytyä MedicineNet-tilauksista milloin tahansa.
Terveydenhuollon ammattilaiset ovat varmoja siitä, että paksusuolensyöpä ei ole tarttuvaa (ihminen ei voi saada tautia syöpäpotilaalta). Jotkut ihmiset ovat todennäköisemmin sairastua paksusuolensyöpään kuin toiset. Tekijöitä, jotka lisäävät henkilön riskiä sairastua paksusuolen syöpään, ovat iän lisääntyminen, afroamerikkalainen rotu, runsas rasvan saanti, suvussa esiintynyt paksusuolensyöpää ja polyyppeja, polyyppien esiintyminen paksusuolessa ja tulehdukselliset suolistosairaudet, ensisijaisesti krooninen haavainen paksusuolitulehdus.
Iän nousu on suurin paksusuolensyövän riskitekijä. Noin 90 % paksusuolensyövistä diagnosoidaan 50 vuoden iän jälkeen.
Afroamerikkalaisilla on suurempi paksusuolen syövän ilmaantuvuus kuin muihin rotuihin kuuluvilla ihmisillä.
Runsasrasvaisen ruokavalion on useissa tutkimuksissa osoitettu altistavan ihmisiä paksusuolen syöpään. Maissa, joissa paksusuolensyövän esiintyvyys on korkea, väestön rasvan saanti on paljon suurempi kuin maissa, joissa syöpätaso on alhainen. Uskotaan, että ohutsuolessa ja paksusuolessa tapahtuvan rasvan sulamisen johtaa syöpää aiheuttavien kemikaalien (karsinogeenien) muodostumiseen. Samoin tutkimukset osoittavat myös, että runsaasti kasviksia ja kuitupitoisia elintarvikkeita, kuten täysjyväleipää ja muroja, sisältävät ruokavaliot sisältävät vähemmän rasvaa, joka tuottaa näitä syöpää aiheuttavia aineita ja voi ehkäistä syöpää aiheuttavien aineiden vaikutuksia. Molemmat vaikutukset auttaisivat vähentämään syöpäriskiä.
Tutkimukset ovat osoittaneet, että useimmat paksusuolensyövät kehittyvät paksusuolen polyypeissä. Siksi hyvänlaatuisten (mutta syöpää edeltävien) kolorektaalisten polyyppien poistaminen voi estää paksusuolen syöpää. Syöpää edeltäviä kolorektaalisia polyyppeja kutsutaan yleisimmin adenomatoottisiksi polyypeiksi. Ne kehittyvät, kun paksusuolen sisäkalvon soluissa tapahtuu kromosomivaurioita. Vaurio tuottaa epänormaaleja soluja, mutta solut eivät ole vielä kehittäneet kykyä levitä, syövän tunnusmerkkiä. Sen sijaan kasvava kudos pysyy paikallisesti polyypin sisällä. Kun kromosomivauriot lisääntyvät edelleen polyypin sisällä, solujen kasvu muuttuu hallitsemattomaksi ja solut alkavat levitä, eli niistä tulee syöpä. Näin ollen paksusuolen polyypit, jotka ovat alun perin hyvänlaatuisia, saavat lisää kromosomivaurioita tullakseen syöpään.
Krooninen haavainen paksusuolentulehdus aiheuttaa paksusuolen sisäkalvon tulehduksen. Suolistosyöpä on kroonisen haavaisen paksusuolentulehduksen tunnustettu komplikaatio. Syövän riski alkaa kasvaa 8-10 vuoden paksusuolentulehduksen jälkeen. Riski sairastua paksusuolensyöpään ulseratiivisesta paksusuolitulehduksesta riippuu myös hänen sairautensa sijainnista ja laajuudesta.
Suurempi syöpäriski on potilailla, joiden suvussa on esiintynyt paksusuolensyöpää, pitkäkestoinen haavainen paksusuolitulehdus, laaja paksusuolen osallisuus haavaiseen paksusuolitulehdukseen ja potilailla, joilla on haavaiseen paksusuolitulehdukseen liittyvä maksasairaus, sklerosoiva kolangiitti.
Koska haavaiseen paksusuolentulehdukseen liittyvillä syövillä on suotuisampi lopputulos varhaisemmassa vaiheessa, paksusuolen vuosittaista tutkimusta suositellaan usein kahdeksan vuoden tunnetun laajan sairauden jälkeen. Näiden tutkimusten aikana otetaan kudosnäytteitä (biopsia) etsimään syöpää edeltäviä muutoksia paksusuolen soluissa. Kun syöpää edeltäviä muutoksia havaitaan, koko paksusuolen poistaminen voi olla tarpeen paksusuolensyövän ehkäisemiseksi.
Ihmisen geneettinen tausta on tärkeä tekijä paksusuolen syövän riskissä. Ensimmäisen asteen sukulaisella on paksusuolen syöpä, varsinkin jos syöpä on diagnosoitu ennen 55 vuoden ikää, suunnilleen kaksinkertaistaa riskin sairastua sairauteen.
Vaikka suvussa esiintynyt paksusuolensyöpä on tärkeä riskitekijä, suurin osa (80 %) paksusuolensyövistä esiintyy satunnaisesti potilailla, joiden suvussa ei ole ollut paksusuolensyöpää. Noin 20 % syövistä liittyy suvussa paksusuolensyöpään.
Kromosomit sisältävät geneettistä tietoa, ja kromosomivauriot aiheuttavat geneettisiä vikoja, jotka johtavat paksusuolen polyyppien muodostumiseen ja myöhemmin paksusuolen syöpään. Satunnaisissa polyypeissä ja syövissä (polyypit ja syövät, jotka kehittyvät ilman sukuhistoriaa) kromosomivauriot ovat hankittuja (kehittyvät solussa aikuisiän aikana). Vaurioituneet kromosomit löytyvät vain polyypeistä ja syövistä, jotka kehittyvät tästä solusta. Mutta perinnöllisissä paksusuolensyövän oireyhtymissä kromosomivauriot periytyvät syntymähetkellä ja ovat läsnä jokaisessa kehon solussa. Potilailla, jotka ovat perineet perinnöllisen paksusuolensyövän oireyhtymän geenit, on riski saada paksusuolen polyyppeja, yleensä nuorena, ja heillä on erittäin suuri riski saada paksusuolen syöpä varhaisessa elämässä; heillä on myös riski saada syöpiä muissa elimissä.
Familiaalinen adenomatoottinen polypoosi (FAP) on perinnöllinen paksusuolensyöpäoireyhtymä, jossa sairastuneille perheenjäsenille kehittyy lukemattomia (satoja, joskus tuhansia) paksusuolen polyyppeja teini-iästä alkaen. Ellei sairautta havaita ja hoideta varhaisessa vaiheessa (hoitoon kuuluu paksusuolen poistaminen), FAP:sta kärsivälle henkilölle kehittyy paksusuolen syöpä näistä polyypeistä. Syöpä kehittyy lähes varmasti 40-vuotiaana. Näillä potilailla on myös riski saada muita syöpiä, kuten kilpirauhasen, mahalaukun ja ampullan syöpiä (sappitiehyen osa, josta se valuu maksasta ohutsuoleen) sekä hyvänlaatuisia kasvaimia, joita kutsutaan desmoidituumoriksi. FAP syntyy mutaatiosta tietyssä geenissä, jota kutsutaan APC-geeniksi. Spesifinen mutaatio voidaan tunnistaa useimmilla ihmisillä asianmukaisilla testeillä, ja tällaista testausta suositellaan henkilöille, joilla on diagnosoitu FAP, sekä heidän perheenjäsenilleen.
Heikennetty familiaalinen adenomatoottinen polypoosi (AFAP) on FAP:n lievempi versio. Sairastuneille jäsenille kehittyy alle 100 paksusuolen polyyppiä. Siitä huolimatta heillä on edelleen erittäin suuri riski sairastua paksusuolensyöpään nuorena. Heillä on myös riski saada mahapolyyppeja ja pohjukaissuolen polyyppeja.
Perinnöllinen ei-polypoosinen paksusuolensyöpä (tunnetaan myös nimellä Lynchin oireyhtymä tai HNPCC) on perinnöllinen paksusuolensyövän oireyhtymä, jossa sairastuneille perheenjäsenille voi kehittyä paksusuolen polyyppeja ja syöpiä, yleensä oikeaan paksusuoleen, 30-40-vuotiaana. Potilailla, joilla on HNPCC, on myös riski sairastua kohtusyöpään, mahasyöpään, munasarjasyöpään ja virtsajohtimien (munuaiset virtsarakkoon yhdistävien putkien) ja sappitiehyiden syöpiin. Ironista kyllä, näyttää siltä, että vaikka paksusuolensyöpää esiintyy useammin potilailla, joilla on HNPCC, nämä syövät voidaan parantaa helpommin kuin "satunnaiset" paksusuolensyövät. HNPCC:hen liittyvät spesifiset geneettiset poikkeavuudet on tunnistettu, ja potilaita ja perheenjäseniä voidaan testata sen määrittämiseksi, onko HNPCC:tä olemassa ja kantavatko perheenjäsenet poikkeavuutta ja voivatko heillä kehittää syöpää.
MYH-polypoosi-oireyhtymä on äskettäin löydetty perinnöllinen paksusuolensyövän oireyhtymä. Sairastuneille jäsenille kehittyy tyypillisesti 10–100 polyyppiä noin 40-vuotiaana, ja heillä on suuri riski sairastua paksusuolensyöpään. Myös tässä geneettinen poikkeavuus on tunnistettu.
On tärkeää muistaa, että suurimmalla osalla paksusuolen syövistä ei ole yhtä tunnistettavaa kromosomipoikkeavuutta, jota voitaisiin etsiä sukulaisista, jotta voitaisiin tunnistaa henkilöt, joilla on riski saada paksusuolen syöpä.
Paksusuolisyöpään liittyvät oireet ovat lukuisia ja epäspesifisiä. Näitä ovat väsymys, heikkous, hengenahdistus, muutokset suolistotottumuksissa, kapea uloste, ripuli tai ummetus, punainen tai tumma veri ulosteessa, painon lasku, vatsakipu, kouristukset tai turvotus. Muilla sairauksilla, kuten ärtyvän suolen oireyhtymällä (spastinen paksusuoli), haavaisella paksusuolitulehduksella, Crohnin taudilla, divertikuloosilla ja mahahaavataudilla, voi olla oireita, jotka jäljittelevät suolistosyöpää.
Kolorektaalisyöpä voi esiintyä useita vuosia ennen oireiden ilmaantumista. Oireet vaihtelevat sen mukaan, missä paksusuolessa kasvain sijaitsee. Oikea kaksoispiste on leveämpi ja joustavampi. Sitä voidaan jopa kutsua suhteellisen tilavaksi muuhun kaksoispisteeseen verrattuna. Oikean paksusuolen syövät voivat kasvaa suuriksi ennen kuin ne aiheuttavat vatsaoireita. Tyypillisesti oikeanpuoleiset syövät aiheuttavat raudanpuuteanemiaa, koska verenhukkaa tapahtuu hitaasti pitkän ajan kuluessa. Raudanpuuteanemia aiheuttaa väsymystä, heikkoutta ja hengenahdistusta. Vasen kaksoispiste on kapeampi kuin oikea. Siksi vasemman paksusuolen syövät aiheuttavat todennäköisemmin osittaista tai täydellistä suolen tukkeumaa. Osittaista suolen tukkeumaa aiheuttavat syövät voivat aiheuttaa oireita, kuten ummetusta, kaventuneita ulosteita, ripulia, vatsakipuja, kouristuksia ja turvotusta. Kirkkaan punainen veri ulosteessa voi myös viitata kasvuun lähellä vasemman paksusuolen tai peräsuolen loppua.
Kun epäillään paksusuolen syöpää, suoritetaan yleensä kolonoskopia diagnoosin vahvistamiseksi ja kasvaimen paikallistamiseksi.
Kolonoskopia on toimenpide, jossa terveydenhuollon ammattilainen työntää pitkän, joustavan katseluputken peräsuoleen tarkastaakseen koko paksusuolen sisäpuolen. Kolonoskopiaa pidetään yleensä tarkempana kuin bariumperäruiskeen röntgenkuvaus, erityisesti pienten polyyppien havaitsemisessa. Jos paksusuolen polyyppeja löytyy, ne yleensä poistetaan kolonoskoopin kautta ja lähetetään patologille. Patologi tutkii polyypit mikroskoopilla syövän varalta. Kolonoskopia on paras menetelmä käytettäväksi, kun epäillään paksusuolen syöpää. Suurin osa kolonoskoopilla poistetuista polyypeista on hyvänlaatuisia, mutta monet ovat syöpää esiasteita. Esisyövän polyyppien poistaminen estää paksusuolensyövän kehittymisen tulevaisuudessa näistä polyypeista.
Sigmoidoskopia on toimenpide, joka suoritetaan lyhyemmällä joustavalla skaalalla vain vasemman paksusuolen ja peräsuolen tutkimiseksi. Se on helpompi valmistaa ja suorittaa kuin täydellinen kolonoskopia, mutta siinä on ilmeisiä rajoituksia, koska se ei ole tarpeeksi pitkä sekä oikean että poikittaisen paksusuolen arvioimiseen. Polyypin poisto ja syöpäbiopsia voidaan tehdä sigmoidoskoopilla.
Jos kolonoskopian aikana löydetään syöpäkasvaimia, voidaan ottaa pieniä kudosnäytteitä (biopsia), jotka voidaan tutkia mikroskoopilla sen määrittämiseksi, onko polyyppi syöpä. Jos paksusuolen syöpä vahvistetaan biopsialla, tehdään staging-tutkimuksia sen selvittämiseksi, onko syöpä jo levinnyt muihin elimiin. Koska paksusuolensyövällä on taipumus levitä keuhkoihin ja maksaan, lavastustestit sisältävät yleensä keuhkojen, maksan ja vatsan CT-skannaukset. Positroniemissiotomografia (PET) -skannauksia, uudempaa testiä, joka etsii lisääntynyttä aineenvaihdunnan aktiivisuutta, joka on yleistä syöpäkudoksessa, käytetään usein myös paksusuolensyövän leviämisen etsimiseen imusolmukkeisiin tai muihin elimiin.
Joskus terveydenhuollon ammattilainen voi saada "kasvainmerkkiaineen" verikokeen, jota kutsutaan karsinoembryoniseksi antigeeniksi (CEA), jos epäillään syöpää. CEA on aine, jota tuottavat jotkin paksu- ja peräsuolen syöpäsolut sekä eräät muut syövät. Sitä esiintyy joskus korkeina pitoisuuksina potilailla, joilla on paksusuolen syöpä, varsinkin kun tauti on levinnyt. Se voi toimia hyödyllisenä testinä, jota seurataan, jos sen todetaan olevan koholla ennen kuin syöpä poistetaan. Kaikilla paksusuolensyöpäpotilailla ei kuitenkaan ole kohonnutta CEA-arvoa, vaikka heidän syöpänsä olisi levinnyt. (Jotkut paksusuolensyövät eivät tuota sitä.) Lisäksi jotkut potilaat ilman syövän CEA-verikoe voi olla kohonnut. Esimerkiksi noin 15 prosentilla tupakoijista on kohonnut CEA ilman paksusuolensyöpää. CEA:ta ei siis käytetä paksusuolensyövän diagnosoimiseen, vaan pikemminkin kolorektaalisyövän hoidon vaikutusten seuraamiseen henkilöllä, jolla on tiedossa oleva sairaus, koska taas joillakin potilailla syöpäkudoksen määrä korreloi CEA:n tason kanssa.
Kun paksusuolen syöpä diagnosoidaan, suoritetaan lisätutkimuksia taudin laajuuden määrittämiseksi. Tätä prosessia kutsutaan lavastuseksi. Vaihe määrittelee, kuinka pitkälle edennyt paksusuolen syöpä on kehittynyt. Kolorektaalisyövän vaiheet vaihtelevat vaiheesta I, vähiten edennyt syöpä, vaiheeseen IV, pisimmällä syöpään.
Jokaisen myöhemmän paksusuolensyövän vaiheen myötä uusiutuvan syövän ja syövän leviämisen (etäpesäkkeiden) aiheuttaman kuoleman riski kasvaa. Kuten todettiin, aikaisemmilla syövillä on pienempi riski uusiutua ja kuolla. Siihen mennessä, kun yksilöllä on vaiheen IV paksusuolensyöpä, ennuste on huono. Kuitenkin myös IV vaiheen paksusuolensyövässä (riippuen siitä, missä syöpä on levinnyt) on mahdollisuus parantua.
Leikkaus on yleisin lääkinnällinen aloitushoito paksusuolensyövän hoidossa. Leikkauksen aikana kasvain, pieni reuna ympäröivästä terveestä suolesta ja viereiset imusolmukkeet poistetaan. Kirurgi yhdistää sitten uudelleen suolen terveet osat. Peräsuolen syöpää sairastavilla potilailla peräsuoli poistetaan joskus pysyvästi, jos syöpä nousee liian alas peräsuolesta. Kirurgi luo sitten vatsan seinämään aukon (kolostomia), jonka kautta paksusuolen kiinteä jäte erittyy. Erityiskoulutuksen saaneet sairaanhoitajat (enterostomaaliset terapeutit) voivat auttaa potilaita sopeutumaan kolostomioihin, ja useimmat koolostomiapotilaat palaavat normaaliin elämäntapaan.
Varhaisen suolistosyövän hoitoon suositellaan leikkausta. Useimmille ihmisille, joilla on varhaisen vaiheen paksusuolensyöpä (vaihe I ja useimmat vaihe II), pelkkä leikkaus on ainoa tarvittava hoito. Kemoterapiaa voidaan tarjota joillekin ihmisille, joilla on vaiheen II syöpä ja joilla on tekijöitä, jotka viittaavat siihen, että heidän kasvaimensa saattaa olla alttiimpi uusiutumiselle. Kuitenkin, kun paksusuolen syöpä on levinnyt paikallisiin imusolmukkeisiin (vaihe III), syövän uusiutumisen riski pysyy korkeana, vaikka kirurgi olisi poistanut kaikki näkyvät todisteet syövästä. Tämä johtuu lisääntyneestä todennäköisyydestä, että pienet syöpäsolut ovat saattaneet karkaamaan ennen leikkausta ja ovat liian pieniä havaittaviksi silloin verikokeilla, skannauksilla tai jopa suoralla tutkimuksella. Niiden esiintyminen on päätelty suuremmasta paksusuolensyövän uusiutumisen riskistä myöhemmin (relapsi). Lääketieteelliset syöpälääkärit (lääketieteelliset onkologit) suosittelevat paksusuolensyövän lisähoitoja kemoterapialla tässä ympäristössä syövän uusiutumisriskin vähentämiseksi. Kemoterapiaan käytetyt lääkkeet pääsevät verenkiertoon ja hyökkäävät kaikkiin paksusuolen syöpäsoluihin, jotka on erittyneet vereen tai imusolmukkeisiin ennen leikkausta, ja yrittävät tappaa ne ennen kuin ne asettuvat muihin elimiin. Tämän strategian, jota kutsutaan adjuvanttikemoterapiaksi, on todistettu vähentävän syövän uusiutumisen riskiä, ja sitä suositellaan kaikille vaiheen III paksusuolensyöpäpotilaille, jotka ovat riittävän terveitä siihen, sekä joillekin korkeamman riskin vaiheen II potilaille, joiden kasvain saattaa olla on todettu tukkineen tai perforoineen suolen seinämää ennen leikkausta.
Paksusuolen syövän hoitoon on olemassa useita eri vaihtoehtoja adjuvanttikemoterapiaan. Hoidot sisältävät kemoterapialääkkeiden yhdistelmän, joka annetaan suun kautta tai laskimoon. Hoidot annetaan tyypillisesti yhteensä kuusi kuukautta. On tärkeää tavata onkologi, joka voi selittää adjuvanttikemoterapiavaihtoehdot sekä huomioitavat sivuvaikutukset, jotta potilaalle voidaan tehdä oikea valinta.
Kemoterapiaa annetaan yleensä terveydenhuollon ammattilaisen klinikalla, sairaalassa avohoidossa tai kotona. Kemoterapiaa annetaan yleensä hoitojaksoissa, joita seuraa toipumisjaksot ilman hoitoa. Kemoterapian sivuvaikutukset vaihtelevat henkilöstä toiseen ja riippuvat myös annetuista aineista. Nykyaikaiset kemoterapia-aineet ovat yleensä hyvin siedettyjä, ja sivuvaikutukset ovat useimmille ihmisille hallittavissa. Yleensä syöpälääkkeet tuhoavat soluja, jotka kasvavat ja jakautuvat nopeasti. Siksi kemoterapia voi vaikuttaa normaaleihin punasoluihin, verihiutaleisiin ja valkosoluihin, jotka myös kasvavat nopeasti. Tämän seurauksena yleisiä sivuvaikutuksia ovat anemia, energian menetys ja alhainen vastustuskyky infektioille. Myös hiusjuurissa ja suolistossa olevat solut jakautuvat nopeasti. Siksi kemoterapia voi aiheuttaa hiustenlähtöä, suun haavaumia, pahoinvointia, oksentelua ja ripulia, mutta nämä vaikutukset ovat ohimeneviä.
Kun paksusuolen syöpä on levinnyt etäälle primaarisesta kasvainpaikasta, sitä kuvataan vaiheen IV sairaudeksi. Nämä primaarisesta kasvaimesta erittyneet etäiset kasvainkertymät ovat kulkeneet veren tai imusolmukkeiden läpi muodostaen uusia kasvaimia muihin elimiin. Siinä vaiheessa paksusuolen syöpä ei ole enää paikallinen ongelma, vaan se on systeeminen ongelma syöpäsolujen kanssa, jotka näkyvät skannauksessa ja joita ei voida havaita, mutta niitä esiintyy todennäköisesti muualla kehossa. Tämän seurauksena useimmissa tapauksissa paras hoito on kemoterapia, joka on systeemistä hoitoa. Metastaattisen paksusuolensyövän kemoterapian on todistettu pidentävän ikää ja parantavan elämänlaatua. Hyvin hoidettuna kemoterapian sivuvaikutukset ovat tyypillisesti paljon pienempiä kuin hallitsemattoman syövän sivuvaikutukset. Kemoterapia ei yksinään pysty parantamaan metastaattista paksusuolen syöpää, mutta se voi yli kaksinkertaistaa elinajanodotuksen ja mahdollistaa hyvän elämänlaadun hoidon aikana.
Kemoterapiavaihtoehdot paksu- ja peräsuolen syövän hoidossa vaihtelevat yksilön muista terveysongelmista riippuen. Hyväkuntoisille henkilöille suositellaan yleensä useiden kemoterapeuttisten lääkkeiden yhdistelmiä, kun taas sairaille ihmisille yksinkertaisempi hoito voi olla paras. Eri monilääkehoito-ohjelmat yhdistävät aineita, joilla on todistetusti aktiivisuus paksusuolen syövän hoidossa, kuten 5-fluorourasiili (5-FU), jota annetaan usein lääkkeen leukovoriinin (kutsutaan myös foliinihapoksi) kanssa tai vastaavan lääkkeen, levoleukovoriinin, kanssa, mikä auttaa tehoamaan paremmin.
Kapesitabiini (Xeloda) on kemoterapialääke, joka annetaan pillerimuodossa. Kun se on joutunut kehoon, se muuttuu 5-FU:ksi, kun se pääsee kasvainkohtaan. Muita kolorektaalisyövän kemoterapialääkkeitä ovat irinotekaani (Camptosar), oksaliplatiini (Eloxatin) ja trifluridiini ja tipirasiili (Lonsurf), yhdistelmälääke pillerimuodossa. Chemotherapy regimens often have acronyms to simplify their nomenclature (such as FOLFOX, FOLFIRI, and FLOX).
Targeted therapies are newer treatments that target specific aspects of the cancer cell, which may be more important to the tumor than the surrounding tissues, offering potentially effective treatments with fewer side effects than traditional chemotherapy. Bevacizumab (Avastin), cetuximab (Erbitux), panitumumab (Vectibix), ramucirumab (Cyramza), regorafenib (Stivarga), and ziv-aflibercept (Zaltrap) are targeted therapies that have been used in the management of advanced colorectal cancer. These newer chemotherapeutic agents most often are combined with standard chemotherapy to enhance their effectiveness.
If the first treatment is not effective, second- and third-line options are available that can confer a benefit to people living with colorectal cancer.
Radiation therapy is the primary treatment of colorectal cancer has been limited to treating cancer of the rectum. As noted earlier, whereas parts of the colon move freely within the abdominal cavity, the rectum is fixed in place within the pelvis. It is in an intimate relationship with many other structures and the pelvis is a more confined space. For these reasons, a tumor in the rectum often is harder to remove surgically because space is smaller and other structures can be involved with cancer. As a result, for all but the earliest rectal cancers, initial chemotherapy and radiation treatments (a local treatment to a defined area) are recommended to try and shrink cancer, allowing for easier removal and lowering the risk of cancer returning locally. Radiation therapy is typically given under the guidance of a radiation specialist called a radiation oncologist. Initially, individuals undergo a planning session, a complicated visit as the doctors and technicians determine exactly where to give the radiation and which structures to avoid. Chemotherapy usually is administered daily while the radiation is delivered. Side effects of radiation treatment include fatigue, temporary or permanent pelvic hair loss, and skin irritation in the treated areas.
Radiation therapy will occasionally be used as a palliative treatment to reduce pain from the recurrent or metastatic colon or rectal cancer.
Follow-up exams are important for people with colorectal cancer. The cancer can come back near the original site, although this is unusual. If the cancer returns, it typically does so in a distant location such as the lymph nodes, liver, or lungs. Individuals diagnosed with colorectal cancer remain at risk of their cancer returning for up to 10 years after their original diagnosis and treatment, although the risk of recurrence is much higher in the first few years. Medical providers in the United States follow patients with physical examinations and blood tests including the CEA (if it was elevated before surgery) tumor marker every three months for the first two years and then with decreasing frequency thereafter. Patients are also followed with colonoscopies (starting one year after their diagnosis) and with CT scans (typically performed at least once yearly for the first two to five years).
If a recurrence is noted either locally or with metastatic spread, individuals may still be treated with the intention of cure. For example, if a new tumor were to recur in the liver, individuals can be treated with a combination of chemotherapy and surgery (or sophisticated radiation techniques) in hopes of eradicating the cancer completely. Evaluation in hospitals of excellence that specialize in liver surgery can help guide these complicated treatment decisions and increase the chances of cure even in the setting of metastatic disease.
In addition to checking for cancer recurrence, patients who have had bowel cancer may have an increased risk of cancer of the prostate, breast, and ovary. Therefore, follow-up examinations in the clinic should include cancer screening for these diseases, as well.
Colorectal cancers are typically slow-growing cancers that take years to develop. Because they grow most often in a step-wise manner, screening can greatly reduce the likelihood of death associated with the disease. Whether with virtual colonoscopy or newer screening techniques, the future must focus first and foremost on better, more comprehensive screening programs that find polyps and early cancers before they become life-threatening. The public also must be educated on the value of screening programs.
For those living with cancer, intensive research is ongoing to better understand cancer biology and genetics so that specific approaches can be developed to attack specific types of cancers and, more importantly, specific individuals' cancers. Each person living with cancer has a disease with a unique biology and genetic code and the secret to better treatments involves unlocking that code. Cancer is very complex and scientists are just beginning to unravel its secrets. Progress is frustratingly slow for those battling the disease. With each passing year, however, our understanding increases and treatments become more refined. If you or your family member is living with colorectal cancer, speak with your doctor about ways you can participate in research through clinical trials to help increase our knowledge and improve our therapies for this difficult disease.
Survival rates for any cancer are often reported by stage, the extent of spread when the cancer is identified. For colon and rectum cancer, around 39% are diagnosed at the local stage, before the cancer has spread outside the local area. The five-year survival for these patients with localized colon and rectum cancer is around 90%.
When the cancer has spread to the regional lymph nodes near the site of origin, the five-year survival rate is about 71%. When the cancer has metastasized to distant sites in the body (stage IV cancer), the five-year survival rate lowers to about 14%.
The most effective prevention for colorectal cancer is early detection and removal of precancerous colorectal polyps before they turn cancerous. Even in cases where cancer has already developed, early detection still significantly improves the chances of a cure by surgically removing the cancer before the disease spreads to other organs.
Regular physical activity is associated with lower risk of colon cancer. Aspirin use also appears to lower the risk of bowel cancer. The use of combined estrogen and progestin in hormone replacement therapy lowers the risk of colon cancer in postmenopausal women. Hormone replacement therapy has risks which must be weighed against this effect, and should be discussed with a doctor.
Blood tests are now available to test for hereditary colon cancer syndromes. Families with multiple members having colon cancers, multiple colon polyps, cancers at young ages, and other cancers such as cancers of the ureters, uterus, duodenum, and more, may take advantage of resources such as genetic counseling, followed possibly by genetic testing. Genetic testing without prior counseling is discouraged because of the extensive family education that is involved and the complicated nature of interpreting the test results.
The advantages of genetic counseling followed by genetic testing include:(1) identifying family members at high risk of developing colon cancer to begin colonoscopies early; (2) identifying high-risk members so that screening may begin to prevent other cancers such as ultrasound tests for uterine cancer, urine examinations for ureter cancer, and upper endoscopies for stomach and duodenal cancers; and (3) alleviating concern for members who test negative for the hereditary genetic defects.
People can change their eating habits by reducing fat intake and increasing fiber (roughage) in their diet. Major sources of fat are meat, eggs, dairy products, salad dressings, and oils used in cooking. Fiber is the insoluble, nondigestible part of plant material present in fruits, vegetables, and whole-grain breads and cereals. It is postulated that high fiber in the diet leads to the creation of bulky stools which can rid the intestines of potential carcinogens. In addition, fiber leads to the more rapid transit of fecal material through the intestine, thus allowing less time for a potential carcinogen to react with the intestinal lining.
The term "screening" is properly applied only to the use of testing to look for evidence of cancer or pre-cancerous polyps in individuals who are asymptomatic and at only average risk for a type of cancer. Those patients who, for example, have a positive family history of colon cancer, or are symptomatic for a colon abnormality, undergo diagnostic testing rather than screening tests.
There are different types of screening tests for colorectal cancer:fecal (stool) occult blood testing, sigmoidoscopy, colonoscopy, digital colonoscopy, and DNA testing of the stool. The US Preventive Services Task Force (USPSTF) recommends strongly that screening begin at age 50 years for average-risk adults, but there is no specific recommendation for one screening test or strategy over another. The USPSTF advises that patients be offered a choice of screening options, using shared decision-making with the patient and physician to arrive at the best choice of screening programs for each individual.
Tumors of the colon and rectum tend to bleed slowly into the stool. The small amount of blood mixed into the stool usually is not visible to the naked eye. The commonly used stool occult blood tests rely on chemical color conversions to detect microscopic amounts of blood. These tests are both convenient and inexpensive. There are two kinds of fecal occult blood tests. The first is known as a guaiac FOBT. In this test, a small amount of stool is smeared on a special card for occult blood testing when a chemical is added to the card. Usually, three consecutive stool cards are collected. The other type of FOBT is an immunochemical test in which a special solution is added to the stool sample and analyzed in the laboratory using antibodies that can detect blood in a stool sample. The immunochemical test is a quantitative test that is more sensitive and specific for the diagnosis of polyps and cancer. It is preferred over the guaiac test.
A person who tests positive for stool occult blood has a 30%-45% chance of having a colon polyp and a 3%-5% chance of having a colon cancer. Colon cancers found under these circumstances tend to be small and not to have spread and have a better long-term prognosis.
It is important to remember that having stool tested positive for occult blood does not necessarily mean a person has colon cancer. Many other conditions can cause occult blood in the stool. However, patients with a positive stool occult blood test should undergo further evaluations to exclude colon cancer and to explain the source of the bleeding. It is also important to realize that stool that has tested negative for occult blood does not mean that colorectal cancer or polyps do not exist. Even under ideal testing conditions, a significant percentage of colon cancers can be missed by stool occult blood screening. Many patients with colon polyps do not have positive stool occult blood. In patients suspected of having colorectal polyps and in those at higher risk for developing colorectal polyps and cancer, screening flexible sigmoidoscopies or colonoscopies are performed even if the FOBT is negative.
Flexible sigmoidoscopy is an exam of the rectum and the lower colon (60 cm or about 2 feet in from the outside) using a viewing tube (a short version of colonoscopy). Research studies have shown that the use of screening flexible sigmoidoscopy can reduce mortality from colon cancer. This is a result of the detection of polyps or early cancers in people with no symptoms. If a polyp or cancer is found, a complete colonoscopy is recommended. The majority of colon polyps can be completely removed at the time of colonoscopy without surgery; however, polyps in the proximal colon that cannot be reached by the sigmoidoscope will be missed. Flexible sigmoidoscopy is often combined with fecal occult blood testing for colorectal cancer screening.
Colonoscopy uses a long (120 cm-150 cm) flexible tube, which can examine the entire length of the colon. Through this tube, the doctor (typically a gastroenterologist) can both view and take pictures of the entire colon and also can take biopsies of colon masses and remove polyps.
Patients with a high risk of developing colorectal cancer may undergo screening colonoscopies starting at earlier ages than 50. For example, patients with a family history of colon cancer are recommended to start screening colonoscopies at an age 10 years before the earliest colon cancer diagnosed in a first-degree relative or five years earlier than the earliest precancerous colon polyp discovered in a first-degree relative. Patients with hereditary colon cancer syndromes such as FAP, AFAP, HNPCC, and MYH are recommended to begin colonoscopies early. The recommendations differ depending on the genetic defect. For example, in people with FAP, colonoscopies may begin during teenage years to look for the development of colon polyps. Patients with a prior history of polyps or colon cancer may also undergo colonoscopies to exclude recurrence. Patients with a long history (greater than 10 years) of chronic ulcerative colitis have an increased risk of colon cancer and should have regular colonoscopies to look for precancerous changes in the colon lining.
Virtual colonoscopy (computerized tomographic or CT colonography) has been utilized in the clinic as a screening technique for colorectal cancer. Virtual colonoscopy employs a CT scan using low doses of radiation with special software to visualize the inside of the colon and look for polyps or masses. The procedure typically involves a bowel preparation with laxatives and/or enemas (although not always) followed by a CT scan after air is introduced into the colon. Because no sedation is necessary, individuals can return to work or other activities upon completion of the test. Virtual colonoscopies appear to be equally able to detect larger polyps (over 1 centimeter in size) as regular colonoscopies. The virtual colonoscopy cannot be used to biopsy or remove tissue from the colon. A follow-up sigmoidoscopy or colonoscopy must be done to accomplish that.
The Cologuard test is available in the U.S. for in-home sample collection for adults over 50 at average risk for colon cancer. The sample is sent to a laboratory for analysis of DNA changes in DNA from cells shed by the intestinal lining into the stool or hemoglobin in the sample. In a research study, the test was able to find 92% of colon cancers and 69% of precancers of the colon. False-negative and false-positive results are also possible.
 Mitä tietää mahasyövän etäterveydestä
Mitä tietää mahasyövän etäterveydestä
 Uudet isäntä-virus-mikrobiomi-vuorovaikutukset COVID-19:n aikana voivat määrittää tuloksen
Uudet isäntä-virus-mikrobiomi-vuorovaikutukset COVID-19:n aikana voivat määrittää tuloksen
 Suolistobakteerien rooli IBS:ssä
Suolistobakteerien rooli IBS:ssä
 Kodun syöpä (kohdun syöpä tai endometriumin syöpä)
Kodun syöpä (kohdun syöpä tai endometriumin syöpä)
 5 syytä investoida suoliston terveyteen juuri nyt
5 syytä investoida suoliston terveyteen juuri nyt
 Kauneus on muutakin kuin ihoa syvältä
Kauneus on muutakin kuin ihoa syvältä
 Sappihapon imeytymishäiriön oireet, diagnoosi- ja hoitoopas
Sappihapon imeytymishäiriö on vähän tunnettu sairaus, mutta vuonna 2014 tehdyssä BS-tutkimuksessa havaittiin, että 1:llä kolmella ihmisellä on diagnooseja, joilla on diagnoos. Sappi on hapan ruuansul
Sappihapon imeytymishäiriön oireet, diagnoosi- ja hoitoopas
Sappihapon imeytymishäiriö on vähän tunnettu sairaus, mutta vuonna 2014 tehdyssä BS-tutkimuksessa havaittiin, että 1:llä kolmella ihmisellä on diagnooseja, joilla on diagnoos. Sappi on hapan ruuansul
 6 parasta suolisto- ja terveyskirjaa, jotka sinun tulee lukea vuonna 2020
Seulo hulluutta kuratoidulla lukulistallamme, joka sisältää parhaita suoliston terveyttä käsitteleviä kirjoja, ruoansulatuskanavan terveyskirjoja ja mikrobiomin hyvinvointia käsitteleviä kirjoja. Ihm
6 parasta suolisto- ja terveyskirjaa, jotka sinun tulee lukea vuonna 2020
Seulo hulluutta kuratoidulla lukulistallamme, joka sisältää parhaita suoliston terveyttä käsitteleviä kirjoja, ruoansulatuskanavan terveyskirjoja ja mikrobiomin hyvinvointia käsitteleviä kirjoja. Ihm
 Mala Xiang Guon ilo ja tuska
Mala Xiang Guo – yksi ruokahuvioista, jonka monet meistä ovat oppineet tuntemaan ja rakastamaan. Tuo kuuma ja mausteinen herkku, joka tuo mausteisen, kihelmöivän ja turruttavan tunteen makuhermoihimme
Mala Xiang Guon ilo ja tuska
Mala Xiang Guo – yksi ruokahuvioista, jonka monet meistä ovat oppineet tuntemaan ja rakastamaan. Tuo kuuma ja mausteinen herkku, joka tuo mausteisen, kihelmöivän ja turruttavan tunteen makuhermoihimme