 A vastagbélrák a rák harmadik fő oka az Egyesült Államokban.
A vastagbélrák a rák harmadik fő oka az Egyesült Államokban.A vastagbélrák jelei és tünetei általában nem specifikusak. Más szavakkal, a jelek és tünetek számos különböző körülmény miatt jelentkezhetnek. Ha a vastagbélrákot korai stádiumban észlelik, előfordulhat, hogy nem is okozott tüneteket. A tünetek attól függően is változhatnak, hogy a vastagbélben melyik helyen található a daganat.
A vastagbélrák néhány tünete és jele:

Testünkben minden nap hatalmas pusztulási és helyreállítási folyamat megy végbe. Az emberi test körülbelül 15 billióból áll sejtek, és minden nap milliárd a sejtek elhasználódnak vagy elpusztulnak. A legtöbb esetben minden alkalommal, amikor egy sejt elpusztul, a szervezet új sejtet hoz létre a helyére, és megpróbál olyan sejtet létrehozni, amely tökéletes mása a megsemmisült sejtnek, mivel a helyettesítő sejtnek képesnek kell lennie ugyanazt a funkciót ellátni, mint a elpusztult sejt. A sejtek cseréjének összetett folyamata során sok hiba lép fel. Annak ellenére, hogy rendkívül elegáns rendszerek működnek a hibák megelőzésére, a test még mindig több tízezer hibát követ el naponta a sejtek cseréje során, akár véletlenszerű hibák miatt, akár azért, mert külső nyomás nehezedik a csere folyamatára, ami elősegíti a hibákat. A legtöbb ilyen hibát további elegáns rendszerekkel korrigálják, vagy a hiba az újonnan készített sejt elpusztulásához vezet, és egy másik normális új sejt keletkezik. Néha azonban elkövetnek egy hibát, amit nem javítanak ki. A kijavítatlan hibák közül sok csekély hatással van az egészségre, de ha a hiba lehetővé teszi az újonnan készített sejt osztódását a normális sejtnövekedést szabályozó fékektől és egyensúlyoktól függetlenül, akkor az a sejt ellenőrizetlen módon szaporodni kezd. Amikor ez megtörténik, daganat (lényegében abnormális sejtek tömege) alakulhat ki.
A daganatok két kategóriába sorolhatók:jóindulatú (nem rákos) és rosszindulatú (rákos) daganatok. Tehát mi a különbség? A válasz az, hogy a jóindulatú daganat csak abban a szövetben nő, amelyből származik. A jóindulatú daganatok néha meglehetősen nagyra vagy gyorsan növekedhetnek, és súlyos tüneteket, akár halált is okozhatnak, bár a legtöbb nem. Például a női méhben lévő mióma daganat a jóindulatú daganatok egyik fajtája. Vérzést vagy fájdalmat okozhat, de soha nem jut el a méhen kívülre, és máshol új daganatként nő. A miómák, mint minden jóindulatú daganat, nem képesek sejteket leadni a vérbe és a nyirokrendszerbe, így nem képesek a test más helyeire utazni és növekedni. A rák viszont olyan sejteket bocsáthat ki, amelyek a véren vagy a nyirokrendszeren áthaladva az elsődleges daganattól távoli szövetekben landolnak, és ezekben a távoli szövetekben új daganatokká nőnek. Ez a távoli szövetekre terjedő folyamat, amelyet metasztázisnak neveznek, a rákos vagy rosszindulatú daganatok meghatározó jellemzője.
A jóindulatú daganatsejtek gyakran viszonylag normálisnak tűnnek, ha mikroszkóp alatt vizsgáljuk őket. A rosszindulatú vagy rákos sejtek általában abnormálisabbnak tűnnek, ha hasonlóképpen nézzük a mikroszkóp alatt.
A rák több mint 100 különböző betegségből álló csoport, hasonlóan a fertőző betegségekhez. A rákot azon szövetek alapján nevezik el, amelyekből az első daganat keletkezik. Ezért a májba terjedő tüdőrák nem májrák, hanem a májra áttétes tüdőrákként írják le, az agyba terjedő emlőrákot pedig nem agydaganatként írják le, hanem inkább olyan emlőrákként írják le, amely áttétes a májra. agy. Minden rák különböző betegség, különböző kezelési lehetőségekkel és eltérő prognózissal (valószínű kimenetel vagy várható élettartam). Valójában minden rákos egyénnek egyedi betegsége van, és az azonos diagnózisú betegek kezelésének relatív sikere vagy hiánya nagyon eltérő lehet. Ennek eredményeként fontos, hogy minden rákos diagnózissal rendelkező személyt egyénként kezeljünk, függetlenül a rák típusától.
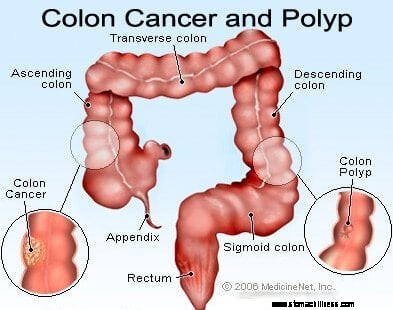 Kép a vastagbélrákról.
Kép a vastagbélrákról.
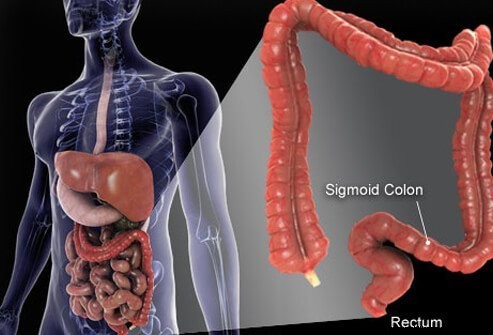
A vastagbél és a végbél a szájtól a végbélnyílásig terjedő cső utolsó részei. Az étel a szájba kerül, ahol megrágják, majd lenyelik. Ezután a nyelőcsövön keresztül a gyomorba jut. A gyomorban az ételt apróbb részecskékre őrlik, majd gondosan ellenőrzött módon bejutnak a vékonybélbe. A vékonybélben megtörténik az élelmiszer végső emésztése és az élelmiszerben lévő tápanyagok felszívódása. Az emésztetlen és fel nem szívódó táplálék a vastagbélbe (vastagbélbe) és végül a végbélbe kerül. A vastagbél elsősorban hulladéktárolóként működik; azonban további vizet, sókat és néhány vitamint tovább távolítanak el. Ezenkívül az emésztetlen élelmiszerek egy részét, például a rostokat a vastagbélbaktériumok megemésztik, és az emésztési termékek egy része felszívódik a vastagbélből és a szervezetbe. (Becslések szerint a táplálékból nyert energia 10%-a a vastagbélben a bakteriális emésztés ezen termékeiből származik.) A megmaradt emésztetlen táplálék, a belek nyálkahártyájából elhaló sejtek és nagyszámú baktérium raktározódik a vastagbélben, ill. majd időszakosan átjutott a végbélbe. A végbélbe jutásuk székletürítést indít el, amely a vastagbél tartalmát székletként üríti ki a szervezetből.
Bár a vastagbél egy cső, szerkezetileg bonyolult cső, inkább egy acélöves radiál gumiabroncs, mint egy kerti tömlő. A cső négy rétegből áll. Az első egy belső sejtréteg, amely az üreget szegélyezi, amelyen keresztül az emésztetlen és emészthető táplálék áthalad, az úgynevezett nyálkahártya. A nyálkahártya egy vékony második réteghez, a submucosa-hoz kapcsolódik, amely egy izomréteghez, a muscularishoz kapcsolódik. Az egész csövet rostos (hegszerű) szövet veszi körül, az úgynevezett serosa. A vastagbél leggyakoribb daganatai (az úgynevezett adenokarcinóma) a nyálkahártyából, a sejtek belső rétegéből származnak. Ezek a sejtek ki vannak téve az élelmiszerekből és baktériumokból származó toxinoknak, valamint a mechanikai kopásnak, és viszonylag gyorsan átfordulnak (elhalnak és kicserélődnek). A hibák (általában a helyettesítő sejteken belüli géneket érintő hibák sorozata) rendellenes sejtekhez és a rákot okozó abnormális sejtek ellenőrizetlen szaporodásához vezetnek. A gyors forgalom több tévedést tesz lehetővé, mint azokhoz a szövetekhez képest, amelyek nem fordulnak olyan gyorsan (például a májszövet).
A vastagbél nagy része a hasüregben található, amelyet peritoneális üregnek neveznek. A vastagbél egyes részei meglehetősen szabadon mozoghatnak a peritoneális üregben, ahogy az emésztetlen táplálék áthalad rajta. Ahogy a vastagbél a végbél felé halad, a peritoneális üreg mögötti szövetekhez rögzül, ezt a területet retroperitoneumnak nevezik. A vastagbél vége, a retroperitoneumban található rész a végbél. A vastagbél többi részétől eltérően a végbelet a körülvevő szövetek rögzítik a helyükön. Elhelyezkedése miatt a végbélrák kezelése gyakran eltér a vastagbél többi részének rákjának kezelésétől.
 A vastagbél keresztmetszetének képe.
A vastagbél keresztmetszetének képe. 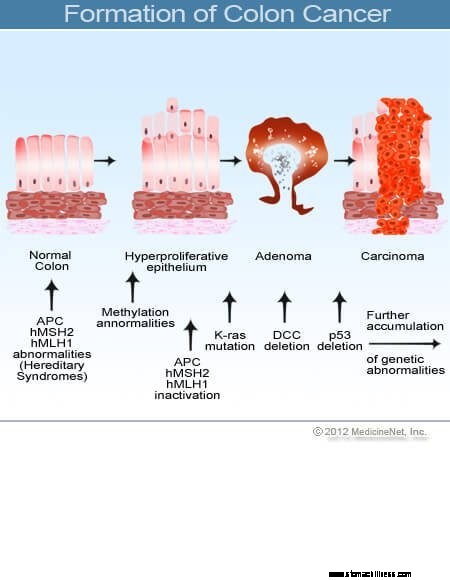 Kép a vastagbélrák kialakulásáról.
Kép a vastagbélrák kialakulásáról.
Az emberi vastagbél (vastagbél) körülbelül 6 láb hosszú.
A vastag- és végbélrák (kolorektális rák) akkor kezdődik, amikor a vastagbél bélésének sejtjeinek normális pótlásának folyamata meghibásodik. A sejtosztódásban gyakran előfordulnak hibák. Rosszul érthető okok miatt néha olyan hibák fordulnak elő, amelyek elkerülik szerkesztőrendszerünket. Amikor ez megtörténik, ezek a sejtek osztódni kezdenek a növekedést szabályozó normál fékektől és egyensúlyoktól függetlenül. Ahogy ezek a kóros sejtek növekednek és osztódnak, polipoknak nevezett növekedésekhez vezethetnek a vastagbélben. A polipok típusa eltérő, de sok olyan rákmegelőző daganat, amely az évek során lassan nő, és nem terjed. A polipok növekedésével a további genetikai mutációk tovább destabilizálják a sejteket. Amikor ezek a rákmegelőző daganatok irányt változtatnak (inkább a cső falába nőnek, mint a közepén lévő térbe), és behatolnak a vastagbél más rétegeibe (például a nyálkahártya alatti vagy az izomrétegbe), a rákmegelőző polip rákossá válik. A legtöbb esetben ez a folyamat lassú, és legalább nyolc-tíz évbe telik, amíg ezekből a korai aberráns sejtekből nyílt rákká fejlődik. A vastag- és végbélrák jellemzően egy adenokarcinóma, ez a kifejezés olyan rákra utal, amely a test bizonyos típusú bélelő szöveteiben alakult ki.
Miután kialakul a vastagbélrák, kétféleképpen kezd el növekedni. Először is, a rák lokálisan növekedhet, átnyúlhat a bélfalon, és behatolhat a szomszédos struktúrákba, így a tömeg (az úgynevezett elsődleges daganat) nagyobb problémát jelent, és nehezebb eltávolítani. A helyi kiterjedés további tüneteket okozhat, például fájdalmat vagy teltségérzetet, a vastagbél perforációját vagy a vastagbél vagy a közeli struktúrák elzáródását. Másodszor, ahogy a rák növekszik, megkezdi az áttétek képződését, naponta több ezer sejtet juttatva a vérbe és a nyirokrendszerbe, ami távoli helyeken rák kialakulását okozhatja. A vastag- és végbélrák leggyakrabban a helyi nyirokcsomókra terjed, mielőtt távoli szervekbe utazna. Amint a helyi nyirokcsomók érintettek, a májba, a hasüregbe és a tüdőbe terjednek a metasztatikus terjedés következő leggyakoribb célpontjai.
A vastag- és végbélrák a harmadik leggyakoribb rák oka az Egyesült Államokban mind a férfiak, mind a nők körében. Évente több mint 135 000 embert érint, ami az összes rák 8%-át jelenti. Az emberek körülbelül 4,3%-ánál vastag- vagy végbélrákot diagnosztizálnak életük egy szakaszában.
A "Küldés" gombra kattintva elfogadom a MedicineNet Általános Szerződési Feltételeit és Adatvédelmi szabályzatát. Azt is elfogadom, hogy e-maileket kapok a MedicineNettől, és tudomásul veszem, hogy bármikor leiratkozhatok a MedicineNet előfizetésekről.
Az egészségügyi szakemberek biztosak abban, hogy a vastagbélrák nem fertőző (az ember nem kaphatja el a betegséget egy rákos betegtől). Egyeseknél nagyobb valószínűséggel alakul ki vastagbélrák, mint másokon. A vastagbélrák kockázatát növelő tényezők közé tartozik az életkor növekedése, az afroamerikai faj, a magas zsírbevitel, a vastagbélrák és polipok családtörténete, a polipok jelenléte a vastagbélben és a gyulladásos bélbetegségek, elsősorban a krónikus fekélyes vastagbélgyulladás.
A vastagbélrák fő kockázati tényezője az életkor növekedése. A vastagbélrákok körülbelül 90%-át 50 éves kor után diagnosztizálják.
Az afro-amerikaiaknál magasabb a vastag- és végbélrák előfordulási gyakorisága, mint más rasszokhoz tartozó embereknél.
Számos kutatási tanulmány kimutatta, hogy a magas zsírtartalmú étrend hajlamosítja az embereket a vastag- és végbélrákra. Azokban az országokban, ahol magas a vastag- és végbélrák aránya, a lakosság zsírbevitele sokkal magasabb, mint azokban az országokban, ahol alacsony a rák aránya. Úgy gondolják, hogy a vékonybélben és a vastagbélben előforduló zsír emésztése rákkeltő vegyi anyagok (rákkeltő anyagok) képződéséhez vezet. Hasonlóképpen, a kutatási tanulmányok azt is feltárják, hogy a zöldségekben gazdag étrendek és a magas rosttartalmú élelmiszerek, például a teljes kiőrlésű kenyér és a gabonafélék kevesebb zsírt tartalmaznak, amely ezeket a rákkeltő anyagokat termeli, és ellensúlyozhatja a rákkeltő anyagok hatását. Mindkét hatás segít csökkenteni a rák kockázatát.
A kutatások kimutatták, hogy a legtöbb vastagbélrák kolorektális polipokban alakul ki. Ezért a jóindulatú (de rákmegelőző) kolorektális polipok eltávolítása megelőzheti a vastagbélrák kialakulását. A rákmegelőző kolorektális polipokat leggyakrabban adenomatózus polipoknak nevezik. Akkor alakulnak ki, amikor a vastagbél belső bélésének sejtjeiben kromoszómakárosodás lép fel. A károsodás abnormális sejteket termel, de a sejtek még nem fejlesztették ki a rákos megbetegedésekre jellemző terjedési képességet. Ehelyett a növekvő szövet a polipon belül lokalizálódik. Amikor a kromoszómakárosodás tovább fokozódik a polipon belül, a sejtnövekedés kontrollálatlanná válik, és a sejtek terjedni kezdenek, vagyis rákossá válnak. Így a kezdetben jóindulatú vastagbélpolipok további kromoszómakárosodást szenvednek, és rákossá válnak.
A krónikus fekélyes vastagbélgyulladás a vastagbél belső nyálkahártyájának gyulladását okozza. A bélrák a krónikus fekélyes vastagbélgyulladás elismert szövődménye. A rák kockázata 8-10 éves vastagbélgyulladás után nő. A vastagbélrák kialakulásának kockázata fekélyes vastagbélgyulladásban szenvedő betegeknél a betegség helyétől és mértékétől is függ.
A rák kockázata nagyobb azoknak a betegeknek, akiknek a családjában előfordult vastagbélrák, hosszan tartó fekélyes vastagbélgyulladás, kiterjedt vastagbél-érintettség a fekélyes vastagbélgyulladásban, valamint a fekélyes vastagbélgyulladással összefüggő májbetegségben, szklerotizáló cholangitisben szenvedők.
Mivel a fekélyes vastagbélgyulladással összefüggő daganatok kedvezőbb kimenetelűek, ha korábbi stádiumban észlelik, a vastagbél éves vizsgálata gyakran javasolt nyolc év kiterjedt betegség után. E vizsgálatok során szövetmintákat (biopsziát) vesznek a vastagbelet bélelő sejtekben a rákmegelőző elváltozások felkutatására. Ha rákmegelőző elváltozásokat találnak, a vastagbél teljes eltávolítására lehet szükség a vastagbélrák megelőzése érdekében.
Az egyén genetikai háttere fontos tényező a vastagbélrák kockázatában. Ha egy első fokú rokonunk vastagbélrákban szenved, különösen, ha a rákot 55 éves kor előtt diagnosztizálták, nagyjából megkétszerezi az állapot kialakulásának kockázatát.
Annak ellenére, hogy a vastagbélrák előfordulása a családban fontos kockázati tényező, a vastagbélrákok többsége (80%) szórványosan fordul elő olyan betegeknél, akiknek a családjában nincs vastagbélrák. A rákos megbetegedések körülbelül 20%-a összefügg a vastagbélrák családi anamnézisével.
A kromoszómák genetikai információkat tartalmaznak, és a kromoszómakárosodás olyan genetikai hibákat okoz, amelyek vastagbélpolipok, majd később vastagbélrák kialakulásához vezetnek. Szórványos polipokban és rákos megbetegedésekben (családi anamnézis hiányában kialakuló polipok és rákos megbetegedések) a kromoszóma károsodások szerzettek (a sejtben a felnőtt élet során alakulnak ki). A sérült kromoszómák csak a polipokban és az abból a sejtből kifejlődő rákban találhatók meg. Az örökletes vastagbélrák-szindrómák esetében azonban a kromoszóma-rendellenességek születéskor öröklődnek, és a test minden sejtjében jelen vannak. Azok a betegek, akik örökölték az örökletes vastagbélrák szindróma géneket, ki vannak téve a vastagbélpolipok kialakulásának kockázatának, általában fiatal korukban, és nagyon nagy a kockázata a vastagbélrák kialakulásának korai életkorukban; más szervekben is fennáll a rák kialakulásának kockázata.
Familiáris adenomatosus polyposis (FAP) Egy örökletes vastag- és végbélrák szindróma, amelyben az érintett családtagoknál számtalan (több száz, néha több ezer) vastagbélpolip alakul ki tizenéves koruktól kezdve. Hacsak nem észlelik és kezelik korán az állapotot (a kezelés magában foglalja a vastagbél eltávolítását), az FAP által érintett személyben szinte biztos, hogy ezekből a polipokból vastagbélrák alakul ki. A rákos megbetegedések szinte biztosan kifejlődnek, mire az ember eléri a 40-es éveit. Ezeknél a betegeknél fennáll a kockázata más rákos megbetegedések, például a pajzsmirigy-, gyomor- és ampullarák (az epevezeték része, ahol a májból a vékonybélbe jut), valamint jóindulatú daganatok, úgynevezett desmoid daganatok kialakulásának kockázata. A FAP az APC génnek nevezett gén mutációjából származik. A specifikus mutáció a legtöbb embernél megfelelő vizsgálattal azonosítható, és az ilyen vizsgálat ajánlott FAP-val diagnosztizált egyének, valamint családtagjaik számára.
Attenuált familiáris adenomatosus polyposis (AFAP) az FAP enyhébb változata. Az érintett tagokban 100-nál kevesebb vastagbélpolip alakul ki. Ennek ellenére még mindig nagyon nagy a kockázata a vastagbélrák kialakulásának fiatal korukban. Emellett fennáll a gyomor- és nyombélpolipok kockázata is.
Örökletes, nem polipózisos vastagbélrák (Lynch-szindróma vagy HNPCC néven is ismert) egy örökletes vastagbélrák szindróma, amelyben az érintett családtagoknál vastagbélpolipok és rákos megbetegedések alakulhatnak ki, általában a jobb vastagbélben, 30-40 éves korukban. A HNPCC-ben szenvedő betegeknél fennáll a méhrák, a gyomorrák, a petefészekrák, valamint az uréterrák (a veséket a hólyaggal összekötő csövek) és az epeutak rák kialakulásának kockázata is. Ironikus módon úgy tűnik, hogy bár a vastagbélrák gyakrabban fordul elő HNPCC-ben szenvedő betegeknél, ezek a rákok könnyebben gyógyíthatók, mint a "sporadikus" vastagbélrák. A HNPCC-vel kapcsolatos specifikus genetikai rendellenességeket azonosították, és a betegek és a családtagok tesztelhetők annak megállapítására, hogy jelen van-e a HNPCC, és hogy a családtagok hordozzák-e a rendellenességet, és valószínűsíthető-e rákos kifejlődés.
MYH polyposis szindróma egy nemrégiben felfedezett örökletes vastag- és végbélrák szindróma. Az érintett tagoknál 40 éves kor körül jellemzően 10-100 polip alakul ki, és nagy a vastagbélrák kialakulásának kockázata. Itt is kimutatták a genetikai rendellenességet.
Fontos megjegyezni, hogy a vastag- és végbélrákos megbetegedések túlnyomó többségében nincs egyetlen azonosítható kromoszóma-rendellenesség, amely a rokonoknál kereshető annak érdekében, hogy azonosítani lehessen a vastag- és végbélrák kockázatának kitett személyeket.
A vastagbélrákhoz kapcsolódó tünet számos és nem specifikus. Ezek közé tartozik a fáradtság, gyengeség, légszomj, székletürítési szokások megváltozása, szűk széklet, hasmenés vagy székrekedés, vörös vagy sötét vér a székletben, fogyás, hasi fájdalom, görcsök vagy puffadás. Más állapotok, például irritábilis bélszindróma (görcsös vastagbél), colitis ulcerosa, Crohn-betegség, divertikulózis és peptikus fekélybetegség olyan tünetekkel járhatnak, amelyek a bélrákot utánozzák.
A vastag- és végbélrák a tünetek megjelenése előtt több évig is jelen lehet. A tünetek attól függően változnak, hogy a vastagbélben hol található a daganat. A jobb vastagbél szélesebb és rugalmasabb. Akár viszonylag tágasnak is nevezhető a vastagbél többi részéhez képest. A jobb vastagbél rákja nagy méretűre nőhet, mielőtt bármilyen hasi tünetet okozna. Jellemzően a jobb oldali rákos megbetegedések vashiányos vérszegénységet okoznak a hosszú időn át tartó lassú vérvesztés miatt. A vashiányos vérszegénység fáradtságot, gyengeséget és légszomjat okoz. A bal vastagbél keskenyebb, mint a jobb vastagbél. Ezért a bal vastagbél rákos megbetegedései nagyobb valószínűséggel okoznak részleges vagy teljes bélelzáródást. A részleges bélelzáródást okozó rákos megbetegedések székrekedést, szűkülő székletet, hasmenést, hasi fájdalmakat, görcsöket és puffadást okozhatnak. Az élénkvörös vér a székletben a bal vastag- vagy végbél végének közeli növekedését is jelezheti.
Ha a vastagbélrák gyanúja merül fel, általában kolonoszkópiát végeznek a diagnózis megerősítésére és a daganat lokalizálására.
A kolonoszkópia egy olyan eljárás, amelynek során az egészségügyi szakember egy hosszú, rugalmas látócsövet helyez a végbélbe, hogy megvizsgálja a teljes vastagbél belsejét. A kolonoszkópiát általában pontosabbnak tekintik, mint a bárium-beöntés röntgensugarait, különösen a kis polipok kimutatásakor. Ha vastagbélpolipokat találnak, általában eltávolítják a kolonoszkópon keresztül, és elküldik a patológusnak. A patológus mikroszkóp alatt megvizsgálja a polipokat, hogy ellenőrizze a rák jelenlétét. A vastagbélrák gyanúja esetén a kolonoszkópia a legjobb eljárás. Míg a kolonoszkóppal eltávolított polipok többsége jóindulatú, sokuk rákmegelőző. A rákmegelőző polipok eltávolítása megakadályozza a vastagbélrák későbbi kialakulását ezekből a polipokból.
A szigmoidoszkópia egy olyan eljárás, amelyet rövidebb, rugalmas hatótávolsággal végeznek csak a bal vastag- és végbél vizsgálatára. Könnyebben előkészíthető és végrehajtható, mint egy teljes kolonoszkópia, de nyilvánvaló korlátai vannak, mivel nem elég hosszú a jobb és a keresztirányú vastagbél vizsgálatához. A polipeltávolítás és a rákbiopszia a szigmoidoszkópon keresztül végezhető el.
Ha a kolonoszkópia során rákos daganatokat találnak, kis szövetmintákat (biopsziát) lehet venni, és mikroszkóp alatt megvizsgálni, hogy megállapítsák, hogy a polip rákos-e. Ha a vastagbélrákot a biopszia megerősíti, stádiumvizsgálatokat végeznek annak megállapítására, hogy a rák átterjedt-e már más szervekre. Mivel a vastag- és végbélrák hajlamos a tüdőre és a májra terjedni, a staging tesztek általában magukban foglalják a tüdő, a máj és a has CT-vizsgálatát. A pozitronemissziós tomográfia (PET) vizsgálatot, egy újabb tesztet, amely a rákos szövetekben gyakori megnövekedett metabolikus aktivitást keresi, szintén gyakran alkalmazzák a vastagbélrák nyirokcsomókra vagy más szervekre való terjedésének vizsgálatára.
Néha az egészségügyi szakember „tumormarker” vérvizsgálatot végezhet, amelyet karcinoembrionális antigénnek (CEA) neveznek, ha fennáll a rák gyanúja. A CEA egy olyan anyag, amelyet egyes vastag- és végbélráksejtek, valamint néhány más típusú rák termelnek. Néha nagy mennyiségben fordul elő vastag- és végbélrákos betegeknél, különösen akkor, ha a betegség már elterjedt. Hasznos tesztként szolgálhat, ha a rák eltávolítása előtt megemelkedett. Azonban nem minden vastag- és végbélrákos betegnél lesz emelkedett a CEA, még akkor sem, ha a rák már elterjedt. (Egyes vastag- és végbélrák nem produkál.) Ezenkívül egyes betegek nélkül rák esetén emelkedett CEA vérvizsgálatot végezhet. Például a dohányosok körülbelül 15%-ának emelkedett CEA-ja lesz vastagbélrák nélkül. Tehát a CEA-t nem a vastag- és végbélrák diagnosztizálására használják, hanem inkább a vastag- és végbélrák kezelésének hatásainak nyomon követésére olyan személyeknél, akiknek ismert a kórtörténete, mivel bizonyos betegeknél ismét a rákos szövet mennyisége korrelál a CEA szintjével. /P>
A vastagbélrák diagnosztizálása esetén további vizsgálatokat végeznek a betegség mértékének meghatározására. Ezt a folyamatot szakaszolásnak nevezik. A stádium meghatározza, hogy milyen előrehaladottá vált a vastagbélrák. A vastagbélrák stádiuma az I. stádiumtól, a legkevésbé előrehaladott ráktól a IV. stádiumig, a legfejlettebb rákig terjed.
A vastagbélrák minden további szakaszával megnő a kiújuló rák és a rák terjedése miatti halálozás (metasztázis) kockázata. Mint már említettük, a korábbi rákos megbetegedések kisebb kockázattal járnak a kiújulás és a halálozás kockázata. Mire az egyén IV. stádiumú vastagbélrákban szenved, a prognózis rossz. Azonban még IV. stádiumú vastag- és végbélrák esetén is (attól függően, hogy a rák hol terjedt el) fennáll a gyógyulás lehetősége.
A műtét a vastagbélrák leggyakoribb kezdeti orvosi kezelése. A műtét során eltávolítják a daganatot, a környező egészséges bél egy kis szélét és a szomszédos nyirokcsomókat. A sebész ezután újra összekapcsolja a bél egészséges szakaszait. A végbélrákban szenvedő betegeknél a végbelet néha végleg eltávolítják, ha a rák túl alacsonyan jelenik meg a végbélben. A sebész ezután egy nyílást (kolosztómiát) hoz létre a hasfalon, amelyen keresztül a vastagbélből származó szilárd hulladék kiválasztódik. Speciálisan képzett nővérek (enterostomális terapeuták) segíthetnek a betegeknek alkalmazkodni a kolosztómiához, és a legtöbb kolosztómiás beteg visszatérhet a normális életmódhoz.
Korai bélrák esetén a műtéti eltávolítás a javasolt kezelés. A legtöbb korai stádiumú vastagbélrákban (I. stádium és a legtöbb II. stádium) szenvedő betegek esetében egyedül a műtét az egyetlen szükséges kezelés. A kemoterápia felkínálható egyes II. stádiumú rákos megbetegedésekben szenvedő betegeknek, akiknél olyan tényezők állnak fenn, amelyek arra utalnak, hogy daganatuk nagyobb a kiújulás kockázatának. Ha azonban a vastagbélrák átterjedt a helyi nyirokcsomókra (III. stádium), a rák visszatérésének kockázata továbbra is magas marad, még akkor is, ha a sebész a rák minden látható bizonyítékát eltávolította. Ez annak köszönhető, hogy megnövekedett annak a valószínűsége, hogy az apró rákos sejtek a műtét előtt kiszabadultak, és túl kicsik ahhoz, hogy vérvizsgálattal, szkenneléssel vagy akár közvetlen vizsgálattal kimutathatóak legyenek. Jelenlétük a vastagbélrák későbbi kiújulásának (relapszus) magasabb kockázatából következtethető. A rákos orvosok (orvosi onkológusok) további vastagbélrák-kezelést javasolnak kemoterápiával ebben a helyzetben, hogy csökkentsék a rák visszatérésének kockázatát. A kemoterápiához használt gyógyszerek bejutnak a véráramba, és megtámadják azokat a vastagbélráksejteket, amelyek a műtét előtt a vérbe vagy a nyirokrendszerbe kerültek, és megpróbálják megölni őket, mielőtt más szervekben beépülnének. Ez a stratégia, az úgynevezett adjuváns kemoterápia, bizonyítottan csökkenti a rák kiújulásának kockázatát, és minden olyan III. stádiumú vastagbélrákban szenvedő beteg számára javasolt, aki elég egészséges ahhoz, hogy átessen rajta, valamint néhány magasabb kockázatú II. kiderült, hogy a műtét előtt elzárta vagy perforálta a bélfalat.
A vastagbélrák kezelésére szolgáló adjuváns kemoterápia többféle lehetőség közül választhat. A kezelések orálisan vagy vénákba adott kemoterápiás gyógyszerek kombinációját foglalják magukban. A kezeléseket általában összesen hat hónapig adják. Fontos, hogy találkozzon egy onkológussal, aki el tudja magyarázni az adjuváns kemoterápia lehetőségeit, valamint azokat a mellékhatásokat, amelyekre figyelni kell, hogy a beteg, mint egyén számára megfelelő döntést lehessen hozni.
A kemoterápiát általában egészségügyi szakember klinikáján, kórházban járóbetegként vagy otthon adják. A kemoterápiát általában kezelési ciklusokban adják, majd gyógyulási időszakokat követnek kezelés nélkül. A kemoterápia mellékhatásai személyenként változnak, és az adott szerektől is függenek. A modern kemoterápiás szerek általában jól tolerálhatók, és a legtöbb embernél a mellékhatások kezelhetők. Általában a rákellenes gyógyszerek elpusztítják a gyorsan növekvő és osztódó sejteket. Ezért a kemoterápia befolyásolhatja a normál vörösvértesteket, vérlemezkéket és fehérvérsejteket, amelyek szintén gyorsan növekednek. Ennek eredményeként a gyakori mellékhatások közé tartozik a vérszegénység, az energiavesztés és a fertőzésekkel szembeni alacsony ellenállás. A hajgyökerekben és a belekben lévő sejtek szintén gyorsan osztódnak. Ezért a kemoterápia hajhullást, szájsebeket, hányingert, hányást és hasmenést okozhat, de ezek a hatások átmenetiek.
Ha a vastag- és végbélrák az elsődleges daganat helyétől távol terjed, IV. stádiumú betegségnek nevezik. Ezek a távoli daganatlerakódások, amelyek az elsődleges daganatból válnak ki, áthaladtak a véren vagy a nyirokrendszeren, és új daganatokat képeztek más szervekben. Ezen a ponton a vastag- és végbélrák már nem helyi probléma, hanem szisztémás probléma a rákos sejtekkel, amelyek a vizsgálat során láthatók és kimutathatatlanok, de valószínűleg máshol jelen vannak a szervezetben. Ennek eredményeként a legtöbb esetben a legjobb kezelés a kemoterápia, amely szisztémás terápia. A metasztatikus vastag- és végbélrák kemoterápiája bizonyítottan meghosszabbítja az életet és javítja az életminőséget. Ha jól kezelik, a kemoterápia mellékhatásai jellemzően sokkal kisebbek, mint az ellenőrizetlen rák mellékhatásai. A kemoterápia önmagában nem képes meggyógyítani az áttétes vastagbélrákot, de több mint megkétszerezheti a várható élettartamot, és jó életminőséget tesz lehetővé a kezelés ideje alatt.
A vastag- és végbélrák kezelésének kemoterápiás lehetőségei az egyén egyéb egészségügyi problémáitól függően változnak. Fittebb egyéneknek általában több kemoterápiás gyógyszer kombinációja javasolt, míg a beteg embereknek az egyszerűbb kezelések lehetnek a legjobbak. Különböző több gyógyszeres kezelési rendek kombinálják a vastag- és végbélrákban bizonyítottan hatásos szereket, mint például az 5-fluorouracilt (5-FU), amelyet gyakran a leukovorin (más néven folinsav) gyógyszerrel vagy egy hasonló, levoleukovorin nevű gyógyszerrel adnak együtt, amely elősegíti a jobb hatást.
A kapecitabin (Xeloda) egy kemoterápiás gyógyszer, amelyet tabletta formájában adnak be. A szervezetbe kerülve 5-FU-ra változik, amikor a daganat helyére kerül. Other chemotherapy drugs for colorectal cancer are irinotecan (Camptosar), oxaliplatin (Eloxatin), and trifluridine and tipiracil (Lonsurf), a combination drug in pill form. Chemotherapy regimens often have acronyms to simplify their nomenclature (such as FOLFOX, FOLFIRI, and FLOX).
Targeted therapies are newer treatments that target specific aspects of the cancer cell, which may be more important to the tumor than the surrounding tissues, offering potentially effective treatments with fewer side effects than traditional chemotherapy. Bevacizumab (Avastin), cetuximab (Erbitux), panitumumab (Vectibix), ramucirumab (Cyramza), regorafenib (Stivarga), and ziv-aflibercept (Zaltrap) are targeted therapies that have been used in the management of advanced colorectal cancer. These newer chemotherapeutic agents most often are combined with standard chemotherapy to enhance their effectiveness.
If the first treatment is not effective, second- and third-line options are available that can confer a benefit to people living with colorectal cancer.
Radiation therapy is the primary treatment of colorectal cancer has been limited to treating cancer of the rectum. As noted earlier, whereas parts of the colon move freely within the abdominal cavity, the rectum is fixed in place within the pelvis. It is in an intimate relationship with many other structures and the pelvis is a more confined space. For these reasons, a tumor in the rectum often is harder to remove surgically because space is smaller and other structures can be involved with cancer. As a result, for all but the earliest rectal cancers, initial chemotherapy and radiation treatments (a local treatment to a defined area) are recommended to try and shrink cancer, allowing for easier removal and lowering the risk of cancer returning locally. Radiation therapy is typically given under the guidance of a radiation specialist called a radiation oncologist. Initially, individuals undergo a planning session, a complicated visit as the doctors and technicians determine exactly where to give the radiation and which structures to avoid. Chemotherapy usually is administered daily while the radiation is delivered. Side effects of radiation treatment include fatigue, temporary or permanent pelvic hair loss, and skin irritation in the treated areas.
Radiation therapy will occasionally be used as a palliative treatment to reduce pain from the recurrent or metastatic colon or rectal cancer.
Follow-up exams are important for people with colorectal cancer. The cancer can come back near the original site, although this is unusual. If the cancer returns, it typically does so in a distant location such as the lymph nodes, liver, or lungs. Individuals diagnosed with colorectal cancer remain at risk of their cancer returning for up to 10 years after their original diagnosis and treatment, although the risk of recurrence is much higher in the first few years. Medical providers in the United States follow patients with physical examinations and blood tests including the CEA (if it was elevated before surgery) tumor marker every three months for the first two years and then with decreasing frequency thereafter. Patients are also followed with colonoscopies (starting one year after their diagnosis) and with CT scans (typically performed at least once yearly for the first two to five years).
If a recurrence is noted either locally or with metastatic spread, individuals may still be treated with the intention of cure. For example, if a new tumor were to recur in the liver, individuals can be treated with a combination of chemotherapy and surgery (or sophisticated radiation techniques) in hopes of eradicating the cancer completely. Evaluation in hospitals of excellence that specialize in liver surgery can help guide these complicated treatment decisions and increase the chances of cure even in the setting of metastatic disease.
In addition to checking for cancer recurrence, patients who have had bowel cancer may have an increased risk of cancer of the prostate, breast, and ovary. Therefore, follow-up examinations in the clinic should include cancer screening for these diseases, as well.
Colorectal cancers are typically slow-growing cancers that take years to develop. Because they grow most often in a step-wise manner, screening can greatly reduce the likelihood of death associated with the disease. Whether with virtual colonoscopy or newer screening techniques, the future must focus first and foremost on better, more comprehensive screening programs that find polyps and early cancers before they become life-threatening. The public also must be educated on the value of screening programs.
For those living with cancer, intensive research is ongoing to better understand cancer biology and genetics so that specific approaches can be developed to attack specific types of cancers and, more importantly, specific individuals' cancers. Each person living with cancer has a disease with a unique biology and genetic code and the secret to better treatments involves unlocking that code. Cancer is very complex and scientists are just beginning to unravel its secrets. Progress is frustratingly slow for those battling the disease. With each passing year, however, our understanding increases and treatments become more refined. If you or your family member is living with colorectal cancer, speak with your doctor about ways you can participate in research through clinical trials to help increase our knowledge and improve our therapies for this difficult disease.
Survival rates for any cancer are often reported by stage, the extent of spread when the cancer is identified. For colon and rectum cancer, around 39% are diagnosed at the local stage, before the cancer has spread outside the local area. The five-year survival for these patients with localized colon and rectum cancer is around 90%.
When the cancer has spread to the regional lymph nodes near the site of origin, the five-year survival rate is about 71%. When the cancer has metastasized to distant sites in the body (stage IV cancer), the five-year survival rate lowers to about 14%.
The most effective prevention for colorectal cancer is early detection and removal of precancerous colorectal polyps before they turn cancerous. Even in cases where cancer has already developed, early detection still significantly improves the chances of a cure by surgically removing the cancer before the disease spreads to other organs.
Regular physical activity is associated with lower risk of colon cancer. Aspirin use also appears to lower the risk of bowel cancer. The use of combined estrogen and progestin in hormone replacement therapy lowers the risk of colon cancer in postmenopausal women. Hormone replacement therapy has risks which must be weighed against this effect, and should be discussed with a doctor.
Blood tests are now available to test for hereditary colon cancer syndromes. Families with multiple members having colon cancers, multiple colon polyps, cancers at young ages, and other cancers such as cancers of the ureters, uterus, duodenum, and more, may take advantage of resources such as genetic counseling, followed possibly by genetic testing. Genetic testing without prior counseling is discouraged because of the extensive family education that is involved and the complicated nature of interpreting the test results.
The advantages of genetic counseling followed by genetic testing include:(1) identifying family members at high risk of developing colon cancer to begin colonoscopies early; (2) identifying high-risk members so that screening may begin to prevent other cancers such as ultrasound tests for uterine cancer, urine examinations for ureter cancer, and upper endoscopies for stomach and duodenal cancers; and (3) alleviating concern for members who test negative for the hereditary genetic defects.
People can change their eating habits by reducing fat intake and increasing fiber (roughage) in their diet. Major sources of fat are meat, eggs, dairy products, salad dressings, and oils used in cooking. Fiber is the insoluble, nondigestible part of plant material present in fruits, vegetables, and whole-grain breads and cereals. It is postulated that high fiber in the diet leads to the creation of bulky stools which can rid the intestines of potential carcinogens. In addition, fiber leads to the more rapid transit of fecal material through the intestine, thus allowing less time for a potential carcinogen to react with the intestinal lining.
The term "screening" is properly applied only to the use of testing to look for evidence of cancer or pre-cancerous polyps in individuals who are asymptomatic and at only average risk for a type of cancer. Those patients who, for example, have a positive family history of colon cancer, or are symptomatic for a colon abnormality, undergo diagnostic testing rather than screening tests.
There are different types of screening tests for colorectal cancer:fecal (stool) occult blood testing, sigmoidoscopy, colonoscopy, digital colonoscopy, and DNA testing of the stool. The US Preventive Services Task Force (USPSTF) recommends strongly that screening begin at age 50 years for average-risk adults, but there is no specific recommendation for one screening test or strategy over another. The USPSTF advises that patients be offered a choice of screening options, using shared decision-making with the patient and physician to arrive at the best choice of screening programs for each individual.
Tumors of the colon and rectum tend to bleed slowly into the stool. The small amount of blood mixed into the stool usually is not visible to the naked eye. The commonly used stool occult blood tests rely on chemical color conversions to detect microscopic amounts of blood. These tests are both convenient and inexpensive. There are two kinds of fecal occult blood tests. The first is known as a guaiac FOBT. In this test, a small amount of stool is smeared on a special card for occult blood testing when a chemical is added to the card. Usually, three consecutive stool cards are collected. The other type of FOBT is an immunochemical test in which a special solution is added to the stool sample and analyzed in the laboratory using antibodies that can detect blood in a stool sample. The immunochemical test is a quantitative test that is more sensitive and specific for the diagnosis of polyps and cancer. It is preferred over the guaiac test.
A person who tests positive for stool occult blood has a 30%-45% chance of having a colon polyp and a 3%-5% chance of having a colon cancer. Colon cancers found under these circumstances tend to be small and not to have spread and have a better long-term prognosis.
It is important to remember that having stool tested positive for occult blood does not necessarily mean a person has colon cancer. Many other conditions can cause occult blood in the stool. However, patients with a positive stool occult blood test should undergo further evaluations to exclude colon cancer and to explain the source of the bleeding. It is also important to realize that stool that has tested negative for occult blood does not mean that colorectal cancer or polyps do not exist. Even under ideal testing conditions, a significant percentage of colon cancers can be missed by stool occult blood screening. Many patients with colon polyps do not have positive stool occult blood. In patients suspected of having colorectal polyps and in those at higher risk for developing colorectal polyps and cancer, screening flexible sigmoidoscopies or colonoscopies are performed even if the FOBT is negative.
Flexible sigmoidoscopy is an exam of the rectum and the lower colon (60 cm or about 2 feet in from the outside) using a viewing tube (a short version of colonoscopy). Research studies have shown that the use of screening flexible sigmoidoscopy can reduce mortality from colon cancer. This is a result of the detection of polyps or early cancers in people with no symptoms. If a polyp or cancer is found, a complete colonoscopy is recommended. The majority of colon polyps can be completely removed at the time of colonoscopy without surgery; however, polyps in the proximal colon that cannot be reached by the sigmoidoscope will be missed. Flexible sigmoidoscopy is often combined with fecal occult blood testing for colorectal cancer screening.
Colonoscopy uses a long (120 cm-150 cm) flexible tube, which can examine the entire length of the colon. Through this tube, the doctor (typically a gastroenterologist) can both view and take pictures of the entire colon and also can take biopsies of colon masses and remove polyps.
Patients with a high risk of developing colorectal cancer may undergo screening colonoscopies starting at earlier ages than 50. For example, patients with a family history of colon cancer are recommended to start screening colonoscopies at an age 10 years before the earliest colon cancer diagnosed in a first-degree relative or five years earlier than the earliest precancerous colon polyp discovered in a first-degree relative. Patients with hereditary colon cancer syndromes such as FAP, AFAP, HNPCC, and MYH are recommended to begin colonoscopies early. The recommendations differ depending on the genetic defect. For example, in people with FAP, colonoscopies may begin during teenage years to look for the development of colon polyps. Patients with a prior history of polyps or colon cancer may also undergo colonoscopies to exclude recurrence. Patients with a long history (greater than 10 years) of chronic ulcerative colitis have an increased risk of colon cancer and should have regular colonoscopies to look for precancerous changes in the colon lining.
Virtual colonoscopy (computerized tomographic or CT colonography) has been utilized in the clinic as a screening technique for colorectal cancer. Virtual colonoscopy employs a CT scan using low doses of radiation with special software to visualize the inside of the colon and look for polyps or masses. The procedure typically involves a bowel preparation with laxatives and/or enemas (although not always) followed by a CT scan after air is introduced into the colon. Because no sedation is necessary, individuals can return to work or other activities upon completion of the test. Virtual colonoscopies appear to be equally able to detect larger polyps (over 1 centimeter in size) as regular colonoscopies. The virtual colonoscopy cannot be used to biopsy or remove tissue from the colon. A follow-up sigmoidoscopy or colonoscopy must be done to accomplish that.
The Cologuard test is available in the U.S. for in-home sample collection for adults over 50 at average risk for colon cancer. The sample is sent to a laboratory for analysis of DNA changes in DNA from cells shed by the intestinal lining into the stool or hemoglobin in the sample. In a research study, the test was able to find 92% of colon cancers and 69% of precancers of the colon. False-negative and false-positive results are also possible.
 Atópia és atópiás betegség
Az atópiás kifejezés az IgE által közvetített testen belüli reakció leírására szolgál, miután külső irritáló anyagoknak van kitéve. Az atópia és az allergia közötti különbség A legtöbbünk ismeri a
Atópia és atópiás betegség
Az atópiás kifejezés az IgE által közvetített testen belüli reakció leírására szolgál, miután külső irritáló anyagoknak van kitéve. Az atópia és az allergia közötti különbség A legtöbbünk ismeri a
 3 módszer a bélrendszer egészségének javítására családok számára (különösen a gyerekek és anyukák)
Gyerekkoromban piszkot ettem. Most, hogy felnőtt vagyok, bárcsak többet ettem volna. Furcsán hangzik, amíg el nem olvassa a tudományt, és belegondol, hogyan éltek az emberek. Ennek tiszteletére sze
3 módszer a bélrendszer egészségének javítására családok számára (különösen a gyerekek és anyukák)
Gyerekkoromban piszkot ettem. Most, hogy felnőtt vagyok, bárcsak többet ettem volna. Furcsán hangzik, amíg el nem olvassa a tudományt, és belegondol, hogyan éltek az emberek. Ennek tiszteletére sze
 5. rész:Ki ne végezze az elemi diétát?
A kutatások kimutatták, hogy az elemi diéta az egyik leghatékonyabb kezelés a SIBO számára. Egyes betegek akár 150 ppm-es csökkenést tapasztalnak a gázok számában egy kezelési kör után. Egy tanulmány
5. rész:Ki ne végezze az elemi diétát?
A kutatások kimutatták, hogy az elemi diéta az egyik leghatékonyabb kezelés a SIBO számára. Egyes betegek akár 150 ppm-es csökkenést tapasztalnak a gázok számában egy kezelési kör után. Egy tanulmány