 Koloncancer är den tredje vanligaste orsaken till cancer i USA
Koloncancer är den tredje vanligaste orsaken till cancer i USATecken och symtom på tjocktarmscancer tenderar inte att vara specifika. Med andra ord kan tecknen och symtomen uppstå på grund av ett antal olika tillstånd. När tjocktarmscancer upptäcks i ett tidigt skede kan det inte ens ha orsakat symtom. Symtomen kan också variera beroende på den specifika platsen i tjocktarmen där tumören sitter.
Några symtom och tecken på tjocktarmscancer är:

Varje dag i våra kroppar sker en massiv process av förstörelse och reparation. Människokroppen består av cirka 15 biljoner celler och varje dag miljarder av celler slits ut eller förstörs. I de flesta fall, varje gång en cell förstörs tillverkar kroppen en ny cell för att ersätta den, och försöker göra en cell som är en perfekt kopia av cellen som förstördes eftersom ersättningscellen måste kunna utföra samma funktion som förstörd cell. Under den komplexa processen att ersätta celler uppstår många fel. Trots anmärkningsvärt eleganta system för att förhindra fel, gör kroppen fortfarande tiotusentals misstag dagligen medan den byter ut celler antingen på grund av slumpmässiga fel eller på grund av att det finns yttre tryck på ersättningsprocessen som främjar fel. De flesta av dessa misstag korrigeras av ytterligare eleganta system eller så leder misstaget till att den nytillverkade cellen dör och en annan normal ny cell produceras. Ibland görs dock ett misstag som inte rättas till. Många av de okorrigerade misstagen har liten effekt på hälsan, men om misstaget tillåter den nytillverkade cellen att dela sig oberoende av de kontroller och balanser som styr normal celltillväxt, kan den cellen börja föröka sig på ett okontrollerat sätt. När detta händer kan en tumör (i huvudsak en massa onormala celler) utvecklas.
Tumörer delas in i två kategorier:det finns godartade (icke-cancerösa) tumörer och maligna (cancerösa) tumörer. Så vad är skillnaden? Svaret är att en godartad tumör växer endast i den vävnad som den uppstår från. Godartade tumörer kan ibland växa sig ganska stora eller snabbt och orsaka allvarliga symtom, till och med dödsfall, även om de flesta inte gör det. Till exempel är en myomtumör i en kvinnas livmoder en typ av godartad tumör. Det kan orsaka blödningar eller smärta, men det kommer aldrig att resa utanför livmodern och växa som en ny tumör någon annanstans. Fibroider, som alla godartade tumörer, saknar kapacitet att sprida celler i blodet och lymfsystemet, så de kan inte resa till andra platser i kroppen och växa. En cancer kan å andra sidan tappa celler som kan färdas genom blodet eller lymfsystemet, landa i vävnader på avstånd från den primära tumören och växa till nya tumörer i dessa avlägsna vävnader. Denna spridningsprocess till avlägsna vävnader, kallad metastaser, är det avgörande kännetecknet för en cancerös eller maligna tumör.
Godartade tumörceller ser ofta relativt normala ut när de undersöks under mikroskop. Maligna celler eller cancerceller ser vanligtvis mer onormala ut när de ses på liknande sätt under mikroskopet.
Cancer är en grupp av mer än 100 olika sjukdomar, ungefär som infektionssjukdomar. Cancer är namngiven av de vävnader från vilka den första tumören uppstår. Därför är en lungcancer som går till levern inte en levercancer utan beskrivs som lungcancer som sprider sig till levern, och en bröstcancer som sprider sig till hjärnan beskrivs inte som en hjärntumör utan snarare som bröstcancer som metastaserar till hjärna. Varje cancerform är en annan sjukdom med olika behandlingsalternativ och varierande prognoser (troliga utfall eller förväntad livslängd). Faktum är att varje individ med cancer har en unik sjukdom, och den relativa framgången eller bristen på behandling för patienter med samma diagnos kan vara mycket olika. Som ett resultat av detta är det viktigt att behandla varje person med en cancerdiagnos som en individ oavsett typ av cancer.
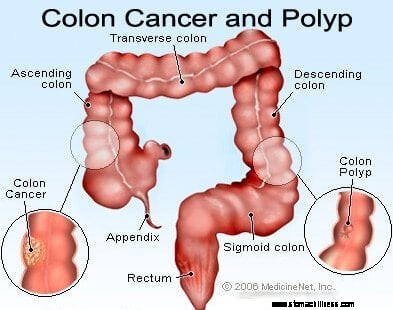 Bild på tjocktarmscancer (kolorektal).
Bild på tjocktarmscancer (kolorektal).
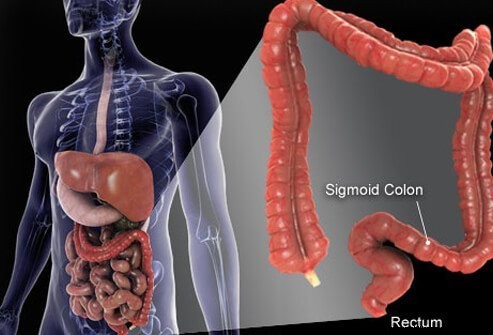
Kolon och ändtarmen är de sista delarna av röret som sträcker sig från munnen till anus. Mat kommer in i munnen där den tuggas och sedan sväljs. Det går sedan genom matstrupen och in i magsäcken. I magen mals maten till mindre partiklar och kommer sedan in i tunntarmen på ett noggrant kontrollerat sätt. I tunntarmen sker slutlig nedbrytning av maten och absorption av de näringsämnen som finns i maten. Maten som inte smälts och absorberas kommer in i tjocktarmen (tjocktarmen) och slutligen ändtarmen. Tjocktarmen fungerar i första hand som en lagringsanläggning för avfall; ytterligare vatten, salter och vissa vitaminer avlägsnas dock ytterligare. Dessutom smälts en del av den osmälta maten, till exempel fibrer, av kolonbakterier och en del av matsmältningsprodukterna absorberas från tjocktarmen och in i kroppen. (Det uppskattas att 10 % av energin som härrör från mat kommer från dessa produkter från bakteriell matsmältning i tjocktarmen.) Den återstående osmälta maten, döende celler från tarmens slemhinna och ett stort antal bakterier lagras i tjocktarmen och passerade sedan periodvis in i ändtarmen. Deras ankomst till ändtarmen initierar en tarmrörelse som tömmer koloninnehållet från kroppen som avföring.
Även om tjocktarmen är ett rör, är det strukturellt ett komplicerat rör, mer som ett radialdäck med stålbälte än en trädgårdsslang. Röret består av fyra lager. Det första är ett inre lager av celler som kantar hålrummet genom vilket den osmälta och smältande maten färdas, kallad slemhinnan. Slemhinnan är fäst vid ett tunt andra lager, submucosa, som är fäst vid ett muskellager, muscularis. Hela röret är omgivet av fibrös (ärrliknande) vävnad som kallas serosa. De vanligaste cancerformerna i tjocktarmen (den typ som kallas adenokarcinom) uppstår från slemhinnan, det inre lagret av celler. Dessa celler utsätts för gifter från mat och bakterier samt mekaniskt slitage, och de vänder relativt snabbt (dör av och ersätts). Misstag (vanligtvis en serie misstag som involverar gener i ersättningscellerna) leder till onormala celler och okontrollerad spridning av de onormala celler som ger upphov till cancer. Den snabba omsättningen gör att fler misstag kan inträffa jämfört med vävnader som inte vänder så snabbt (till exempel levervävnad).
Det mesta av tjocktarmen vilar inuti en hålighet i buken som kallas bukhålan. Delar av tjocktarmen kan röra sig ganska fritt i peritonealhålan när den osmälta maten passerar genom den. När tjocktarmen går mot ändtarmen, fixeras den till vävnaderna bakom bukhålan, ett område som kallas retroperitoneum. Änddelen av tjocktarmen, den del som finns i retroperitoneum, är ändtarmen. Till skillnad från mycket av resten av tjocktarmen, är ändtarmen fixerad på plats av vävnaderna som omger den. På grund av dess läge är behandling för rektalcancer ofta annorlunda än behandling för cancer i resten av tjocktarmen.
 Bild av kolontvärsnitt.
Bild av kolontvärsnitt. 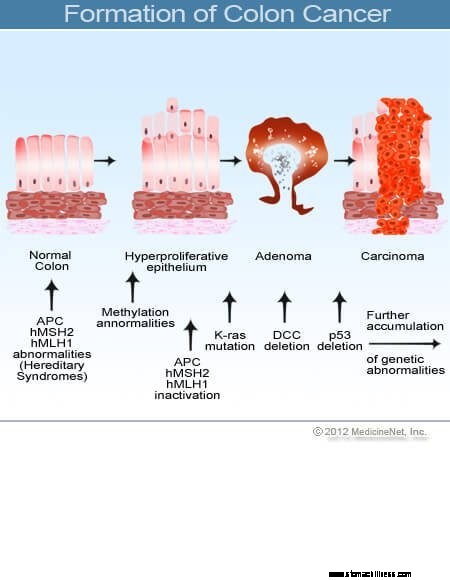 Bild på bildning av tjocktarmscancer.
Bild på bildning av tjocktarmscancer.
Människans tjocktarm (kolon) är cirka 6 fot lång.
Cancer i tjocktarmen och ändtarmen (kolorektal cancer) startar när processen med normal ersättning av tjocktarmsceller går snett. Misstag i celldelning förekommer ofta. Av skäl som är dåligt förstådda uppstår ibland misstag som undkommer våra redigeringssystem. När detta inträffar börjar dessa celler att dela sig oberoende av de normala kontrollerna och balanserna som styr tillväxten. När dessa onormala celler växer och delar sig kan de leda till tillväxt i tjocktarmen som kallas polyper. Polyper varierar i typ, men många är precancerösa tumörer som växer långsamt under loppet av år och inte sprider sig. När polyper växer destabiliserar ytterligare genetiska mutationer cellerna ytterligare. När dessa precancerösa tumörer ändrar riktning (växer in i rörets vägg snarare än in i utrymmet i mitten av det) och invaderar andra lager av tjocktarmen (som submucosa eller muskelskikt), har den precancerösa polypen blivit cancerös. I de flesta fall är denna process långsam och tar minst åtta till 10 år att utvecklas från dessa tidiga avvikande celler till en uppriktig cancer. Kolorektal cancer är vanligtvis ett adenokarcinom, en term som hänvisar till en cancer som har bildats i vissa typer av fodervävnader i kroppen.
När en kolorektal cancer väl bildas börjar den växa på två sätt. För det första kan cancern växa lokalt och sträcka sig genom tarmväggen och invadera intilliggande strukturer, vilket gör massan (kallad primärtumör) mer av ett problem och svårare att ta bort. Lokal förlängning kan orsaka ytterligare symtom som smärta eller fyllighet, perforering av tjocktarmen eller blockeringar av tjocktarmen eller närliggande strukturer. För det andra, när cancern växer börjar den processen med metastasering, och släpper ut tusentals celler om dagen i blodet och lymfsystemet som kan orsaka cancer att bildas på avlägsna platser. Kolorektal cancer sprids oftast först till lokala lymfkörtlar innan de reser till avlägsna organ. När lokala lymfkörtlar väl är inblandade är spridning till levern, bukhålan och lungan de näst vanligaste destinationerna för metastatisk spridning.
Kolorektal cancer är den tredje vanligaste orsaken till cancer i USA hos både män och kvinnor. Den drabbar över 135 000 personer årligen, vilket motsvarar 8 % av alla cancerfall. Cirka 4,3 % av människorna kommer att få diagnosen tjock- eller ändtarmscancer någon gång i livet.
Genom att klicka på "Skicka" godkänner jag MedicineNets villkor och sekretesspolicy. Jag samtycker också till att ta emot e-postmeddelanden från MedicineNet och jag förstår att jag kan välja bort MedicineNet-prenumerationer när som helst.
Vårdpersonal är säkra på att kolorektal cancer inte är smittsam (en person kan inte få sjukdomen från en cancerpatient). Vissa människor är mer benägna att utveckla kolorektal cancer än andra. Faktorer som ökar en persons risk för kolorektal cancer inkluderar stigande ålder, afroamerikansk ras, högt fettintag, en familjehistoria av kolorektal cancer och polyper, närvaron av polyper i tjocktarmen och inflammatoriska tarmsjukdomar, främst kronisk ulcerös kolit.
Ökande ålder är den främsta riskfaktorn för kolorektal cancer. Omkring 90 % av kolorektal cancer diagnostiseras efter 50 års ålder.
Afroamerikaner har en högre förekomst av kolorektal cancer än människor av andra raser.
Dieter med hög fetthalt har i många forskningsstudier visat sig predisponera människor för kolorektal cancer. I länder med hög andel tjock- och ändtarmscancer är befolkningens fettintag mycket högre än i länder med låg cancerfrekvens. Man tror att nedbrytningen av fett som sker i tunntarmen och tjocktarmen leder till bildning av cancerframkallande kemikalier (cancerframkallande ämnen). På samma sätt visar forskningsstudier också att dieter med mycket grönsaker och fiberrik mat som fullkornsbröd och spannmål innehåller mindre fett som producerar dessa cancerframkallande ämnen och kan motverka effekterna av cancerframkallande ämnen. Båda effekterna skulle bidra till att minska risken för cancer.
Forskning har visat att de flesta kolorektala cancerformer utvecklas i kolorektala polyper. Därför kan borttagning av godartade (men precancerösa) kolorektala polyper förhindra kolorektal cancer. Precancerösa kolorektala polyper kallas oftast adenomatösa polyper. De utvecklas när kromosomskador uppstår i cellerna i tjocktarmens inre slemhinna. Skadan producerar onormala celler, men cellerna har ännu inte utvecklat förmågan att sprida sig, cancerns kännetecken. Istället förblir den växande vävnaden lokaliserad i polypen. När kromosomskadorna ökar ytterligare inom polypen, blir celltillväxten okontrollerad, och cellerna börjar spridas, det vill säga de blir cancer. Således får tjocktarmspolyper som initialt är godartade ytterligare kromosomskador och blir cancerösa.
Kronisk ulcerös kolit orsakar inflammation i det inre slemhinnan i tjocktarmen. Tarmcancer är en erkänd komplikation av kronisk ulcerös kolit. Risken för cancer börjar öka efter åtta till 10 år av kolit. Risken att utveckla tjocktarmscancer hos en patient med ulcerös kolit är också relaterad till platsen och omfattningen av hans eller hennes sjukdom.
Patienter med högre risk för cancer är de med en familjehistoria av tjocktarmscancer, långvarig ulcerös kolit, omfattande koloninblandning med ulcerös kolit och de med ulcerös kolit-associerad leversjukdom, skleroserande kolangit.
Eftersom cancer i samband med ulcerös kolit har ett gynnsammare resultat när de upptäcks i ett tidigare skede, rekommenderas ofta årliga undersökningar av tjocktarmen efter åtta år med känd omfattande sjukdom. Under dessa undersökningar tas vävnadsprover (biopsier) för att söka efter precancerösa förändringar i cellerna som kantar tjocktarmen. När precancerösa förändringar upptäcks kan det vara nödvändigt att ta bort hela tjocktarmen för att förhindra tjocktarmscancer.
En persons genetiska bakgrund är en viktig faktor i risken för tjocktarmscancer. Att ha en första gradens släkting med kolorektal cancer, särskilt om cancern diagnostiserades före 55 års ålder, fördubblar ungefär risken för att utveckla tillståndet.
Även om en familjehistoria av tjocktarmscancer är en viktig riskfaktor, förekommer en majoritet (80%) av tjocktarmscancer sporadiskt hos patienter utan familjehistoria av tjocktarmscancer. Ungefär 20 % av cancerfallen är förknippade med en familjehistoria av tjocktarmscancer.
Kromosomer innehåller genetisk information, och kromosomskador orsakar genetiska defekter som leder till bildandet av tjocktarmspolyper och senare tjocktarmscancer. Vid sporadiska polyper och cancerformer (polyper och cancer som utvecklas i avsaknad av familjehistoria) förvärvas kromosomskadorna (utvecklas i en cell under vuxenlivet). De skadade kromosomerna kan bara hittas i polyperna och de cancerformer som utvecklas från den cellen. Men vid ärftliga tjocktarmscancersyndrom ärvs kromosomdefekterna vid födseln och finns i varje cell i kroppen. Patienter som har ärvt generna för ärftligt tjocktarmscancersyndrom löper risk att utveckla tjocktarmspolyper, vanligtvis i unga åldrar, och löper mycket hög risk att utveckla tjocktarmscancer tidigt i livet; de löper också risk att utveckla cancer i andra organ.
Familiär adenomatös polypos (FAP) är ett ärftligt kolorektalcancersyndrom där de drabbade familjemedlemmarna kommer att utveckla otaliga antal (hundratals, ibland tusentals) tjocktarmspolyper med början under tonåren. Om inte tillståndet upptäcks och behandlas tidigt (behandling innebär avlägsnande av tjocktarmen), är en person som drabbas av FAP nästan säker på att utveckla tjocktarmscancer från dessa polyper. Cancer utvecklas nästan säkert när en person är i 40-årsåldern. Dessa patienter löper också risk att utveckla andra cancerformer som cancer i sköldkörteln, magen och ampullen (en del av gallgången där den rinner ut i tunntarmen från levern) samt godartade tumörer som kallas desmoida tumörer. FAP uppstår från en mutation i en specifik gen som kallas APC-genen. Den specifika mutationen kan identifieras hos de flesta människor med lämpliga tester, och sådana tester rekommenderas för individer som diagnostiserats med FAP såväl som deras familjemedlemmar.
Attenuerad familjär adenomatös polypos (AFAP) är en mildare version av FAP. Drabbade medlemmar utvecklar färre än 100 kolonpolyper. Ändå löper de fortfarande mycket hög risk att utveckla tjocktarmscancer i unga år. De riskerar också att få magpolyper och duodenalpolyper.
Äftlig tjocktarmscancer utan polypos (även känd som Lynch syndrom eller HNPCC) är ett ärftligt kolorektalcancersyndrom där drabbade familjemedlemmar kan utveckla kolonpolyper och cancer, vanligtvis i höger kolon, i 30- till 40-årsåldern. Patienter med HNPCC löper också risk att utveckla livmodercancer, magcancer, äggstockscancer och cancer i urinledarna (rören som förbinder njurarna med urinblåsan) och gallgångarna. Ironiskt nog verkar det som att medan tjocktarmscancer förekommer oftare hos patienter med HNPCC, kan dessa cancerformer lättare botas än "sporadiska" tjocktarmscancer. De specifika genetiska avvikelser som är förknippade med HNPCC har identifierats och patienter och familjemedlemmar kan testas för att fastställa om HNPCC är närvarande och om familjemedlemmar bär på avvikelsen och sannolikt utvecklar cancer.
MYH polypossyndrom är ett nyligen upptäckt ärftligt kolorektalcancersyndrom. Drabbade medlemmar utvecklar vanligtvis 10 till 100 polyper vid cirka 40 års ålder och löper hög risk att utveckla tjocktarmscancer. Även här har den genetiska abnormiteten identifierats.
Det är viktigt att komma ihåg att den överväldigande majoriteten av kolorektal cancer inte har en enda identifierbar kromosomavvikelse som man kan leta efter hos släktingar för att identifiera individer med risk för kolorektal cancer.
Kolorektal cancerrelaterade symtom är många och ospecifika. De inkluderar trötthet, svaghet, andnöd, förändringar i tarmvanor, trång avföring, diarré eller förstoppning, rött eller mörkt blod i avföringen, viktminskning, buksmärtor, kramper eller uppblåsthet. Andra tillstånd som colon irritabile (spastisk kolon), ulcerös kolit, Crohns sjukdom, divertikulos och magsår kan ha symtom som efterliknar tarmcancer.
Kolorektal cancer kan finnas i flera år innan symtom utvecklas. Symtomen varierar beroende på var i tjocktarmen tumören sitter. Höger kolon är bredare och mer flexibel. Den kan till och med kallas relativt rymlig jämfört med resten av tjocktarmen. Cancer i höger kolon kan växa till stora storlekar innan de orsakar några buksymtom. Vanligtvis orsakar högersidiga cancerformer järnbristanemi på grund av långsam förlust av blod under en lång tidsperiod. Järnbristanemi orsakar trötthet, svaghet och andnöd. Vänster kolon är smalare än höger kolon. Därför är det mer sannolikt att cancer i vänster kolon orsakar partiell eller fullständig tarmobstruktion. Cancer som orsakar partiell tarmobstruktion kan orsaka symtom på förstoppning, förträngd avföring, diarré, buksmärtor, kramper och uppblåsthet. Klarrött blod i avföringen kan också indikera en tillväxt nära slutet av vänster kolon eller ändtarm.
När tjocktarmscancer misstänks utförs vanligtvis en koloskopi för att bekräfta diagnosen och lokalisera tumören.
Koloskopi är en procedur där en vårdpersonal för in ett långt, flexibelt synrör i ändtarmen i syfte att inspektera insidan av hela tjocktarmen. Koloskopi anses generellt vara mer exakt än bariumlavemangsröntgenstrålar, särskilt vid upptäckt av små polyper. Om kolonpolyper hittas tas de vanligtvis bort genom koloskopet och skickas till patologen. Patologen undersöker polyperna under mikroskopet för att se efter cancer. Koloskopi är det bästa förfarandet att använda när man misstänker cancer i tjocktarmen. Medan majoriteten av polyperna som tas bort genom koloskop är godartade, är många precancerösa. Avlägsnande av precancerösa polyper förhindrar framtida utveckling av tjocktarmscancer från dessa polyper.
Sigmoidoskopi är en procedur som utförs med ett kortare flexibelt omfattning för att bara undersöka vänster kolon och ändtarmen. Den är lättare att förbereda för och utföra än en komplett koloskopi men har uppenbara begränsningar när det gäller att inte vara tillräckligt lång för att bedöma både högra och tvärgående tjocktarmen. Polypborttagning och cancerbiopsi kan utföras genom sigmoidoskopet.
Om cancerösa utväxter hittas under koloskopi kan små vävnadsprover (biopsier) tas och undersökas i mikroskop för att avgöra om polypen är cancerös. Om tjocktarmscancer bekräftas av en biopsi görs stadieundersökningar för att avgöra om cancern redan har spridit sig till andra organ. Eftersom kolorektal cancer tenderar att spridas till lungorna och levern, inkluderar iscensättningstester vanligtvis datortomografi av lungor, lever och buken. Positron emission tomography (PET), ett nyare test som letar efter den ökade metaboliska aktiviteten som är vanlig i cancervävnad, används också ofta för att leta efter spridning av tjocktarmscancer till lymfkörtlar eller andra organ.
Ibland kan hälso- och sjukvårdspersonalen få ett "tumörmarkör"-blodprov som kallas ett karcinoembryonalt antigen (CEA) om det finns misstanke om cancer. CEA är ett ämne som produceras av vissa kolon- och rektalcancerceller samt av vissa andra typer av cancer. Det finns ibland i höga nivåer hos patienter med kolorektal cancer, särskilt när sjukdomen har spridit sig. Det kan fungera som ett användbart test att följa om det visar sig vara förhöjt innan cancern tas bort. Men inte alla patienter med kolorektal cancer kommer att ha en förhöjd CEA även om deras cancer har spridit sig. (Vissa kolorektala cancerformer producerar det inte.) Dessutom har vissa patienter utan cancer kan ha ett förhöjt CEA-blodprov. Cirka 15 % av rökarna kommer till exempel att ha en förhöjd CEA utan tjocktarmscancer. Så CEA används inte för att diagnostisera kolorektal cancer utan snarare för att följa effekterna av behandling av kolorektal cancer hos någon med en känd historia av sjukdomen eftersom, återigen, hos vissa patienter korrelerar mängden cancervävnad med nivån av CEA.
När kolorektal cancer diagnostiseras, utförs ytterligare tester för att bestämma omfattningen av sjukdomen. Denna process kallas iscensättning. Staging avgör hur avancerad kolorektal cancer har blivit. Stadieindelningen för kolorektal cancer sträcker sig från stadium I, den minst framskridna cancern, till stadium IV, den mest avancerade cancern.
Med varje efterföljande stadium av tjocktarmscancer ökar risken för återkommande cancer och död på grund av spridning av cancer (metastaser). Som nämnts har tidigare cancerformer lägre risk för återfall och död. När en individ har stadium IV kolorektal cancer är prognosen dålig. Men även i stadium IV kolorektal cancer (beroende på var cancern har spridit sig) finns möjligheten till bot.
Kirurgi är den vanligaste initiala medicinska behandlingen för kolorektal cancer. Under operationen avlägsnas tumören, en liten marginal av den omgivande friska tarmen och intilliggande lymfkörtlar. Kirurgen återansluter sedan de friska delarna av tarmen. Hos patienter med ändtarmscancer avlägsnas ibland ändtarmen permanent om cancer uppstår för lågt i ändtarmen. Kirurgen skapar sedan en öppning (kolostomi) på bukväggen genom vilken fast avfall från tjocktarmen utsöndras. Specialutbildade sjuksköterskor (enterostomala terapeuter) kan hjälpa patienter att anpassa sig till kolostomier, och de flesta patienter med kolostomi återgår till en normal livsstil.
För tidiga tarmcancer är den rekommenderade behandlingen kirurgiskt avlägsnande. För de flesta med tjocktarmscancer i tidigt stadium (stadium I och de flesta stadium II) är enbart kirurgi den enda behandlingen som krävs. Kemoterapi kan erbjudas vissa personer med stadium II-cancer som har faktorer som tyder på att deras tumör kan ha högre risk för återfall. Men när tjocktarmscancer har spridit sig till lokala lymfkörtlar (stadium III), är risken att cancern återkommer fortfarande hög även om alla synliga bevis på cancern har tagits bort av kirurgen. Detta beror på en ökad sannolikhet att små cancerceller kan ha rymt före operationen och är för små för att upptäckas vid den tidpunkten genom blodprover, skanningar eller till och med direkt undersökning. Deras närvaro härleds från en högre risk för återfall av tjocktarmscancern vid ett senare tillfälle (återfall). Medicinska cancerläkare (medicinska onkologer) rekommenderar ytterligare tjocktarmscancerbehandlingar med kemoterapi i denna inställning för att minska risken för cancerns återkomst. Läkemedel som används för kemoterapi kommer in i blodomloppet och attackerar eventuella tjocktarmscancerceller som hälldes ut i blodet eller lymfsystemet före operationen och försöker döda dem innan de etablerar sig i andra organ. Denna strategi, som kallas adjuvant kemoterapi, har visat sig sänka risken för återfall av cancer och rekommenderas för alla patienter med stadium III tjocktarmscancer som är friska nog att genomgå den, såväl som för vissa patienter med högre risk stadium II vars tumör kan ha visat sig ha blockerat eller perforerat tarmväggen före operationen.
Det finns flera olika alternativ för adjuvant kemoterapi för behandling av tjocktarmscancer. Behandlingarna involverar en kombination av kemoterapiläkemedel som ges oralt eller i venerna. Behandlingarna ges vanligtvis under totalt sex månader. Det är viktigt att träffa en onkolog som kan förklara alternativ för adjuvant kemoterapi samt biverkningar att se upp för så att rätt val kan göras för en patient som individ.
Kemoterapi ges vanligtvis på en vårdpersonals klinik, på sjukhuset som öppenvård eller i hemmet. Kemoterapi ges vanligtvis i behandlingscykler följt av återhämtningsperioder utan behandling. Biverkningar av kemoterapi varierar från person till person och beror också på vilka medel som ges. Moderna kemoterapimedel tolereras vanligtvis väl, och biverkningar för de flesta är hanterbara. I allmänhet förstör läkemedel mot cancer celler som snabbt växer och delar sig. Därför kan normala röda blodkroppar, blodplättar och vita blodkroppar som också växer snabbt påverkas av kemoterapi. Som ett resultat inkluderar vanliga biverkningar anemi, förlust av energi och låg motståndskraft mot infektioner. Celler i hårrötterna och tarmarna delar sig också snabbt. Därför kan kemoterapi orsaka håravfall, munsår, illamående, kräkningar och diarré, men dessa effekter är övergående.
När kolorektal cancer väl har spridit sig långt från det primära tumörstället, beskrivs det som stadium IV-sjukdom. Dessa avlägsna tumöravlagringar, utgjutna från den primära tumören, har färdats genom blodet eller lymfsystemet och bildar nya tumörer i andra organ. Vid den tidpunkten är kolorektal cancer inte längre ett lokalt problem utan är istället ett systemiskt problem med cancerceller både synliga på skanning och oupptäckbara, men sannolikt närvarande på andra ställen i kroppen. Som ett resultat, i de flesta fall, är den bästa behandlingen kemoterapi, som är systemisk terapi. Kemoterapi vid metastaserad kolorektal cancer har visat sig förlänga livet och förbättra livskvaliteten. Om det hanteras väl är biverkningarna av kemoterapi vanligtvis mycket mindre än biverkningarna av okontrollerad cancer. Enbart kemoterapi kan inte bota metastaserad tjocktarmscancer, men den kan mer än fördubbla den förväntade livslängden och möjliggöra god livskvalitet under behandlingstiden.
Kemoterapialternativ för behandling av kolorektal cancer varierar beroende på andra hälsoproblem som en individ står inför. För friskare individer rekommenderas vanligtvis kombinationer av flera kemoterapeutiska läkemedel, medan enklare behandlingar kan vara bäst för sjukare personer. Olika multiläkemedelsregimer kombinerar medel med bevisad aktivitet vid kolorektal cancer såsom 5-fluorouracil (5-FU), som ofta ges tillsammans med läkemedlet leucovorin (även kallat folinsyra) eller ett liknande läkemedel som heter levoleucovorin, vilket hjälper det att fungera bättre.
Capecitabine (Xeloda), är ett kemoterapiläkemedel som ges i pillerform. Once in the body, it is changed to 5-FU when it gets to the tumor site. Other chemotherapy drugs for colorectal cancer are irinotecan (Camptosar), oxaliplatin (Eloxatin), and trifluridine and tipiracil (Lonsurf), a combination drug in pill form. Chemotherapy regimens often have acronyms to simplify their nomenclature (such as FOLFOX, FOLFIRI, and FLOX).
Targeted therapies are newer treatments that target specific aspects of the cancer cell, which may be more important to the tumor than the surrounding tissues, offering potentially effective treatments with fewer side effects than traditional chemotherapy. Bevacizumab (Avastin), cetuximab (Erbitux), panitumumab (Vectibix), ramucirumab (Cyramza), regorafenib (Stivarga), and ziv-aflibercept (Zaltrap) are targeted therapies that have been used in the management of advanced colorectal cancer. These newer chemotherapeutic agents most often are combined with standard chemotherapy to enhance their effectiveness.
If the first treatment is not effective, second- and third-line options are available that can confer a benefit to people living with colorectal cancer.
Radiation therapy is the primary treatment of colorectal cancer has been limited to treating cancer of the rectum. As noted earlier, whereas parts of the colon move freely within the abdominal cavity, the rectum is fixed in place within the pelvis. It is in an intimate relationship with many other structures and the pelvis is a more confined space. For these reasons, a tumor in the rectum often is harder to remove surgically because space is smaller and other structures can be involved with cancer. As a result, for all but the earliest rectal cancers, initial chemotherapy and radiation treatments (a local treatment to a defined area) are recommended to try and shrink cancer, allowing for easier removal and lowering the risk of cancer returning locally. Radiation therapy is typically given under the guidance of a radiation specialist called a radiation oncologist. Initially, individuals undergo a planning session, a complicated visit as the doctors and technicians determine exactly where to give the radiation and which structures to avoid. Chemotherapy usually is administered daily while the radiation is delivered. Side effects of radiation treatment include fatigue, temporary or permanent pelvic hair loss, and skin irritation in the treated areas.
Radiation therapy will occasionally be used as a palliative treatment to reduce pain from the recurrent or metastatic colon or rectal cancer.
Follow-up exams are important for people with colorectal cancer. The cancer can come back near the original site, although this is unusual. If the cancer returns, it typically does so in a distant location such as the lymph nodes, liver, or lungs. Individuals diagnosed with colorectal cancer remain at risk of their cancer returning for up to 10 years after their original diagnosis and treatment, although the risk of recurrence is much higher in the first few years. Medical providers in the United States follow patients with physical examinations and blood tests including the CEA (if it was elevated before surgery) tumor marker every three months for the first two years and then with decreasing frequency thereafter. Patients are also followed with colonoscopies (starting one year after their diagnosis) and with CT scans (typically performed at least once yearly for the first two to five years).
If a recurrence is noted either locally or with metastatic spread, individuals may still be treated with the intention of cure. For example, if a new tumor were to recur in the liver, individuals can be treated with a combination of chemotherapy and surgery (or sophisticated radiation techniques) in hopes of eradicating the cancer completely. Evaluation in hospitals of excellence that specialize in liver surgery can help guide these complicated treatment decisions and increase the chances of cure even in the setting of metastatic disease.
In addition to checking for cancer recurrence, patients who have had bowel cancer may have an increased risk of cancer of the prostate, breast, and ovary. Therefore, follow-up examinations in the clinic should include cancer screening for these diseases, as well.
Colorectal cancers are typically slow-growing cancers that take years to develop. Because they grow most often in a step-wise manner, screening can greatly reduce the likelihood of death associated with the disease. Whether with virtual colonoscopy or newer screening techniques, the future must focus first and foremost on better, more comprehensive screening programs that find polyps and early cancers before they become life-threatening. The public also must be educated on the value of screening programs.
For those living with cancer, intensive research is ongoing to better understand cancer biology and genetics so that specific approaches can be developed to attack specific types of cancers and, more importantly, specific individuals' cancers. Each person living with cancer has a disease with a unique biology and genetic code and the secret to better treatments involves unlocking that code. Cancer is very complex and scientists are just beginning to unravel its secrets. Progress is frustratingly slow for those battling the disease. With each passing year, however, our understanding increases and treatments become more refined. If you or your family member is living with colorectal cancer, speak with your doctor about ways you can participate in research through clinical trials to help increase our knowledge and improve our therapies for this difficult disease.
Survival rates for any cancer are often reported by stage, the extent of spread when the cancer is identified. For colon and rectum cancer, around 39% are diagnosed at the local stage, before the cancer has spread outside the local area. The five-year survival for these patients with localized colon and rectum cancer is around 90%.
When the cancer has spread to the regional lymph nodes near the site of origin, the five-year survival rate is about 71%. When the cancer has metastasized to distant sites in the body (stage IV cancer), the five-year survival rate lowers to about 14%.
The most effective prevention for colorectal cancer is early detection and removal of precancerous colorectal polyps before they turn cancerous. Even in cases where cancer has already developed, early detection still significantly improves the chances of a cure by surgically removing the cancer before the disease spreads to other organs.
Regular physical activity is associated with lower risk of colon cancer. Aspirin use also appears to lower the risk of bowel cancer. The use of combined estrogen and progestin in hormone replacement therapy lowers the risk of colon cancer in postmenopausal women. Hormone replacement therapy has risks which must be weighed against this effect, and should be discussed with a doctor.
Blood tests are now available to test for hereditary colon cancer syndromes. Families with multiple members having colon cancers, multiple colon polyps, cancers at young ages, and other cancers such as cancers of the ureters, uterus, duodenum, and more, may take advantage of resources such as genetic counseling, followed possibly by genetic testing. Genetic testing without prior counseling is discouraged because of the extensive family education that is involved and the complicated nature of interpreting the test results.
The advantages of genetic counseling followed by genetic testing include:(1) identifying family members at high risk of developing colon cancer to begin colonoscopies early; (2) identifying high-risk members so that screening may begin to prevent other cancers such as ultrasound tests for uterine cancer, urine examinations for ureter cancer, and upper endoscopies for stomach and duodenal cancers; and (3) alleviating concern for members who test negative for the hereditary genetic defects.
People can change their eating habits by reducing fat intake and increasing fiber (roughage) in their diet. Major sources of fat are meat, eggs, dairy products, salad dressings, and oils used in cooking. Fiber is the insoluble, nondigestible part of plant material present in fruits, vegetables, and whole-grain breads and cereals. It is postulated that high fiber in the diet leads to the creation of bulky stools which can rid the intestines of potential carcinogens. In addition, fiber leads to the more rapid transit of fecal material through the intestine, thus allowing less time for a potential carcinogen to react with the intestinal lining.
The term "screening" is properly applied only to the use of testing to look for evidence of cancer or pre-cancerous polyps in individuals who are asymptomatic and at only average risk for a type of cancer. Those patients who, for example, have a positive family history of colon cancer, or are symptomatic for a colon abnormality, undergo diagnostic testing rather than screening tests.
There are different types of screening tests for colorectal cancer:fecal (stool) occult blood testing, sigmoidoscopy, colonoscopy, digital colonoscopy, and DNA testing of the stool. The US Preventive Services Task Force (USPSTF) recommends strongly that screening begin at age 50 years for average-risk adults, but there is no specific recommendation for one screening test or strategy over another. The USPSTF advises that patients be offered a choice of screening options, using shared decision-making with the patient and physician to arrive at the best choice of screening programs for each individual.
Tumors of the colon and rectum tend to bleed slowly into the stool. The small amount of blood mixed into the stool usually is not visible to the naked eye. The commonly used stool occult blood tests rely on chemical color conversions to detect microscopic amounts of blood. These tests are both convenient and inexpensive. There are two kinds of fecal occult blood tests. The first is known as a guaiac FOBT. In this test, a small amount of stool is smeared on a special card for occult blood testing when a chemical is added to the card. Usually, three consecutive stool cards are collected. The other type of FOBT is an immunochemical test in which a special solution is added to the stool sample and analyzed in the laboratory using antibodies that can detect blood in a stool sample. The immunochemical test is a quantitative test that is more sensitive and specific for the diagnosis of polyps and cancer. It is preferred over the guaiac test.
A person who tests positive for stool occult blood has a 30%-45% chance of having a colon polyp and a 3%-5% chance of having a colon cancer. Colon cancers found under these circumstances tend to be small and not to have spread and have a better long-term prognosis.
It is important to remember that having stool tested positive for occult blood does not necessarily mean a person has colon cancer. Many other conditions can cause occult blood in the stool. However, patients with a positive stool occult blood test should undergo further evaluations to exclude colon cancer and to explain the source of the bleeding. It is also important to realize that stool that has tested negative for occult blood does not mean that colorectal cancer or polyps do not exist. Even under ideal testing conditions, a significant percentage of colon cancers can be missed by stool occult blood screening. Many patients with colon polyps do not have positive stool occult blood. In patients suspected of having colorectal polyps and in those at higher risk for developing colorectal polyps and cancer, screening flexible sigmoidoscopies or colonoscopies are performed even if the FOBT is negative.
Flexible sigmoidoscopy is an exam of the rectum and the lower colon (60 cm or about 2 feet in from the outside) using a viewing tube (a short version of colonoscopy). Research studies have shown that the use of screening flexible sigmoidoscopy can reduce mortality from colon cancer. This is a result of the detection of polyps or early cancers in people with no symptoms. If a polyp or cancer is found, a complete colonoscopy is recommended. The majority of colon polyps can be completely removed at the time of colonoscopy without surgery; however, polyps in the proximal colon that cannot be reached by the sigmoidoscope will be missed. Flexible sigmoidoscopy is often combined with fecal occult blood testing for colorectal cancer screening.
Colonoscopy uses a long (120 cm-150 cm) flexible tube, which can examine the entire length of the colon. Through this tube, the doctor (typically a gastroenterologist) can both view and take pictures of the entire colon and also can take biopsies of colon masses and remove polyps.
Patients with a high risk of developing colorectal cancer may undergo screening colonoscopies starting at earlier ages than 50. For example, patients with a family history of colon cancer are recommended to start screening colonoscopies at an age 10 years before the earliest colon cancer diagnosed in a first-degree relative or five years earlier than the earliest precancerous colon polyp discovered in a first-degree relative. Patients with hereditary colon cancer syndromes such as FAP, AFAP, HNPCC, and MYH are recommended to begin colonoscopies early. The recommendations differ depending on the genetic defect. For example, in people with FAP, colonoscopies may begin during teenage years to look for the development of colon polyps. Patients with a prior history of polyps or colon cancer may also undergo colonoscopies to exclude recurrence. Patients with a long history (greater than 10 years) of chronic ulcerative colitis have an increased risk of colon cancer and should have regular colonoscopies to look for precancerous changes in the colon lining.
Virtual colonoscopy (computerized tomographic or CT colonography) has been utilized in the clinic as a screening technique for colorectal cancer. Virtual colonoscopy employs a CT scan using low doses of radiation with special software to visualize the inside of the colon and look for polyps or masses. The procedure typically involves a bowel preparation with laxatives and/or enemas (although not always) followed by a CT scan after air is introduced into the colon. Because no sedation is necessary, individuals can return to work or other activities upon completion of the test. Virtual colonoscopies appear to be equally able to detect larger polyps (over 1 centimeter in size) as regular colonoscopies. The virtual colonoscopy cannot be used to biopsy or remove tissue from the colon. A follow-up sigmoidoscopy or colonoscopy must be done to accomplish that.
The Cologuard test is available in the U.S. for in-home sample collection for adults over 50 at average risk for colon cancer. The sample is sent to a laboratory for analysis of DNA changes in DNA from cells shed by the intestinal lining into the stool or hemoglobin in the sample. In a research study, the test was able to find 92% of colon cancers and 69% of precancers of the colon. False-negative and false-positive results are also possible.
 krydda ditt liv med kryddiga buffalo wings
Den här veckan, Rebecca Coomes hjälper dig att sätta Grand i Grand Final Weekend med hennes sensationella Spicy Buffalo Wings med Ranch Dressing . Oavsett om du tittar på Rugby League eller AFL kan du
krydda ditt liv med kryddiga buffalo wings
Den här veckan, Rebecca Coomes hjälper dig att sätta Grand i Grand Final Weekend med hennes sensationella Spicy Buffalo Wings med Ranch Dressing . Oavsett om du tittar på Rugby League eller AFL kan du
 COVID-19:Ser fortfarande patienter men begränsar kapaciteten
Att säkerställa våra patienters säkerhet är vår högsta prioritet, och även om Coronaviruset är ett bekymmer för vissa vill vi att du ska veta att vi noga övervakar situationen och vidtar åtgärder för
COVID-19:Ser fortfarande patienter men begränsar kapaciteten
Att säkerställa våra patienters säkerhet är vår högsta prioritet, och även om Coronaviruset är ett bekymmer för vissa vill vi att du ska veta att vi noga övervakar situationen och vidtar åtgärder för
 Behandling av sura uppstötningar hos spädbarn och barn
Spädbarn har vanligtvis sura uppstötningar, men de flesta behöver inte behandling som medicin. Om de spottar upp efter matning men går upp i vikt, sover bra och inte är kinkiga, är de troligen bra. Me
Behandling av sura uppstötningar hos spädbarn och barn
Spädbarn har vanligtvis sura uppstötningar, men de flesta behöver inte behandling som medicin. Om de spottar upp efter matning men går upp i vikt, sover bra och inte är kinkiga, är de troligen bra. Me