 Rakovina hrubého čreva je treťou najčastejšou príčinou rakoviny v USA
Rakovina hrubého čreva je treťou najčastejšou príčinou rakoviny v USAPríznaky a symptómy rakoviny hrubého čreva nebývajú špecifické. Inými slovami, príznaky a symptómy sa môžu vyskytnúť v dôsledku množstva rôznych stavov. Keď sa rakovina hrubého čreva zistí v počiatočných štádiách, nemusí ani spôsobiť príznaky. Symptómy sa môžu líšiť aj podľa konkrétneho miesta v hrubom čreve, kde sa nádor nachádza.
Niektoré príznaky a príznaky rakoviny hrubého čreva sú:

Každý deň v našom tele prebieha masívny proces ničenia a opravy. Ľudské telo sa skladá z približne 15 biliónov buniek a každý deň miliardy buniek sa opotrebujú alebo zničia. Vo väčšine prípadov vždy, keď je bunka zničená, telo vytvorí novú bunku, aby ju nahradilo, pričom sa snaží vytvoriť bunku, ktorá je dokonalou kópiou bunky, ktorá bola zničená, pretože náhradná bunka musí byť schopná vykonávať rovnakú funkciu ako bunka. zničená bunka. Počas zložitého procesu výmeny buniek dochádza k mnohým chybám. Napriek pozoruhodne elegantným systémom, ktoré zabraňujú chybám, telo stále robí desiatky tisíc chýb denne pri výmene buniek buď z dôvodu náhodných chýb, alebo preto, že na proces výmeny sú vyvíjané vonkajšie tlaky, ktoré spôsobujú chyby. Väčšina z týchto chýb je opravená dodatočnými elegantnými systémami alebo chyba vedie k smrti novovytvorenej bunky a vzniká ďalšia normálna nová bunka. Niekedy sa však stane chyba, ktorá sa neodstráni. Mnohé z neopravených chýb majú malý vplyv na zdravie, ale ak chyba umožní novovytvorenej bunke deliť sa nezávisle od kontrol a rovnováh, ktoré kontrolujú normálny rast buniek, táto bunka sa môže začať nekontrolovane množiť. Keď k tomu dôjde, môže sa vyvinúť nádor (v podstate množstvo abnormálnych buniek).
Nádory spadajú do dvoch kategórií:existujú benígne (nerakovinové) nádory a malígne (rakovinové) nádory. Aký je teda rozdiel? Odpoveď je, že nezhubný nádor rastie len v tkanive, z ktorého vychádza. Benígne nádory môžu niekedy rásť pomerne veľké alebo rýchlo a spôsobiť vážne symptómy, dokonca smrť, hoci väčšina z nich nie. Napríklad fibroidný nádor v maternici ženy je typom nezhubného nádoru. Môže spôsobiť krvácanie alebo bolesť, ale nikdy sa nedostane mimo maternice a nevyrastie ako nový nádor inde. Fibrómy, ako všetky nezhubné nádory, nemajú schopnosť vylučovať bunky do krvi a lymfatického systému, takže nie sú schopné cestovať na iné miesta v tele a rásť. Na druhej strane rakovina môže vylučovať bunky, ktoré môžu cestovať cez krvný alebo lymfatický systém, pristáť v tkanivách vzdialených od primárneho nádoru a v týchto vzdialených tkanivách prerásť do nových nádorov. Tento proces šírenia sa do vzdialených tkanív, nazývaný metastázy, je charakteristickým znakom rakovinového alebo malígneho nádoru.
Benígne nádorové bunky často vyzerajú relatívne normálne, keď sa skúmajú pod mikroskopom. Malígne alebo rakovinové bunky zvyčajne vyzerajú abnormálnejšie, keď sa na ne pod mikroskopom pozeráme podobne.
Rakovina je skupina viac ako 100 rôznych chorôb, podobne ako infekčné choroby. Rakoviny sú pomenované podľa tkanív, z ktorých vzniká prvý nádor. Preto rakovina pľúc, ktorá sa dostane do pečene, nie je rakovina pečene, ale je opísaná ako rakovina pľúc metastázujúca do pečene a rakovina prsníka, ktorá sa šíri do mozgu, nie je opísaná ako mozgový nádor, ale skôr ako rakovina prsníka metastázujúca do pečene. mozog. Každá rakovina je iné ochorenie s rôznymi možnosťami liečby a rôznymi prognózami (pravdepodobné výsledky alebo očakávaná dĺžka života). V skutočnosti má každý jednotlivec s rakovinou jedinečné ochorenie a relatívna úspešnosť alebo nedostatočná liečba u pacientov s rovnakou diagnózou môže byť veľmi odlišná. V dôsledku toho je dôležité liečiť každého človeka s diagnózou rakoviny ako jednotlivca bez ohľadu na typ rakoviny.
 Obrázok rakoviny hrubého čreva (kolorektálneho).
Obrázok rakoviny hrubého čreva (kolorektálneho).
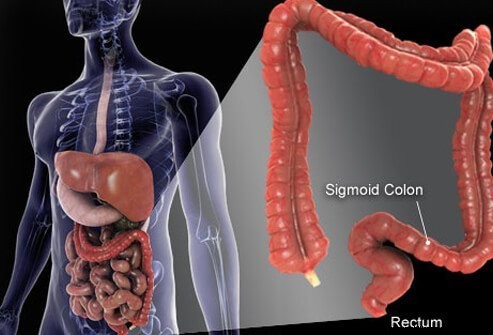
Hrubé črevo a konečník sú posledné časti trubice, ktorá sa tiahne od úst po konečník. Jedlo vstupuje do úst, kde sa žuva a potom prehltne. Potom prechádza cez pažerák a do žalúdka. V žalúdku sa potrava melie na menšie čiastočky a následne sa starostlivo kontrolovaným spôsobom dostáva do tenkého čreva. V tenkom čreve nastáva konečné trávenie potravy a vstrebávanie živín obsiahnutých v potrave. Potrava, ktorá sa nestrávi a nevstrebe, sa dostáva do hrubého čreva (hrubého čreva) a nakoniec do konečníka. Hrubé črevo funguje predovšetkým ako úložisko odpadu; dodatočná voda, soli a niektoré vitamíny sa však ďalej odstraňujú. Okrem toho časť nestrávenej potravy, napríklad vláknina, je trávená baktériami v hrubom čreve a časť produktov trávenia je absorbovaná z hrubého čreva a do tela. (Odhaduje sa, že 10 % energie získanej z potravy pochádza z týchto produktov bakteriálneho trávenia v hrubom čreve.) Zvyšná nestrávená potrava, odumierajúce bunky z výstelky čriev a veľké množstvo baktérií sú uložené v hrubom čreve a potom periodicky prechádzal do konečníka. Ich príchod do konečníka iniciuje pohyb čriev, ktorý vyprázdňuje obsah hrubého čreva z tela vo forme stolice.
Hoci hrubé črevo je trubica, je to štrukturálne komplikovaná trubica, ktorá skôr pripomína radiálnu pneumatiku s oceľovým pásom než záhradnú hadicu. Rúrka sa skladá zo štyroch vrstiev. Prvým je vnútorná vrstva buniek, ktorá vystiela dutinu, cez ktorú putuje nestrávená a natrávená potrava, nazývaná sliznica. Sliznica je pripojená k tenkej druhej vrstve, submukóze, ktorá je pripojená k vrstve svalu, muscularis. Celá trubica je obklopená vláknitým (jazvovitým) tkanivom nazývaným seróza. Najčastejšie rakoviny hrubého čreva (typ nazývaný adenokarcinóm) vznikajú zo sliznice, vnútornej vrstvy buniek. Tieto bunky sú vystavené toxínom z potravy a baktérií, ako aj mechanickému opotrebovaniu a pomerne rýchlo sa obracajú (odumierajú a nahrádzajú sa). Chyby (zvyčajne séria chýb zahŕňajúcich gény v náhradných bunkách) vedú k abnormálnym bunkám a nekontrolovanej proliferácii abnormálnych buniek, ktoré spôsobujú rakovinu. Rýchly obrat umožňuje výskyt väčšieho počtu chýb v porovnaní s tkanivami, ktoré sa neobracajú tak rýchlo (napríklad pečeňové tkanivo).
Väčšina hrubého čreva spočíva vo vnútri dutiny v bruchu nazývanej peritoneálna dutina. Časti hrubého čreva sa môžu celkom voľne pohybovať v peritoneálnej dutine, keď ňou prechádza nestrávená potrava. Keď hrubé črevo smeruje ku konečníku, fixuje sa na tkanivá za peritoneálnou dutinou, oblasť nazývaná retroperitoneum. Koncová časť hrubého čreva, časť, ktorá sa nachádza v retroperitoneu, je konečník. Na rozdiel od väčšiny zvyšku hrubého čreva je konečník fixovaný na mieste tkanivami, ktoré ho obklopujú. Kvôli svojej polohe je liečba rakoviny konečníka často iná ako liečba rakoviny zvyšku hrubého čreva.
 Obrázok prierezu hrubého čreva.
Obrázok prierezu hrubého čreva. 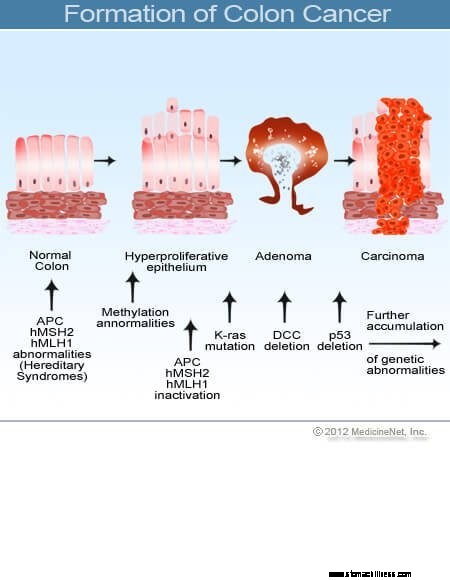 Obrázok vzniku rakoviny hrubého čreva.
Obrázok vzniku rakoviny hrubého čreva.
Ľudské hrubé črevo (hrubé črevo) je dlhé asi 6 stôp.
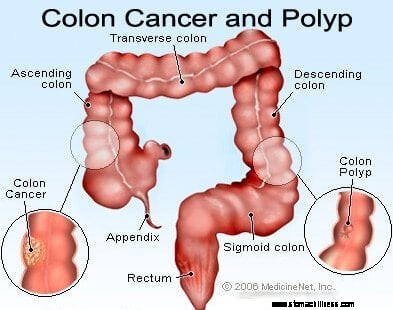
Rakovina hrubého čreva a konečníka (kolorektálny karcinóm) začína vtedy, keď sa proces normálnej výmeny buniek výstelky hrubého čreva pokazí. Často sa vyskytujú chyby pri delení buniek. Z dôvodov, ktoré nie sú dostatočne pochopené, sa niekedy vyskytnú chyby, ktoré uniknú našim redakčným systémom. Keď k tomu dôjde, tieto bunky sa začnú deliť nezávisle od bežných kontrol a rovnováh, ktoré riadia rast. Keď tieto abnormálne bunky rastú a delia sa, môžu viesť k rastu v hrubom čreve nazývanom polypy. Polypy sa líšia typom, ale mnohé z nich sú prekancerózne nádory, ktoré rastú pomaly v priebehu rokov a nerozširujú sa. Ako polypy rastú, ďalšie genetické mutácie ďalej destabilizujú bunky. Keď tieto prekancerózne nádory zmenia smer (rastú skôr do steny trubice než do priestoru v jej strede) a napadnú ďalšie vrstvy hrubého čreva (ako je submukóza alebo svalová vrstva), prekancerózny polyp sa stal rakovinovým. Vo väčšine prípadov je tento proces pomalý a trvá najmenej 8 až 10 rokov, kým sa z týchto skorých aberantných buniek vyvinie úprimná rakovina. Kolorektálny karcinóm je typicky adenokarcinóm, termín, ktorý označuje rakovinu, ktorá sa vytvorila v určitých typoch výstelkových tkanív v tele.
Akonáhle sa vytvorí kolorektálny karcinóm, začne rásť dvoma spôsobmi. Po prvé, rakovina môže rásť lokálne a šíriť sa cez stenu čreva a napádať susedné štruktúry, čím sa hmota (nazývaná primárny nádor) stáva väčším problémom a je ťažšie ju odstrániť. Lokálne rozšírenie môže spôsobiť ďalšie príznaky, ako je bolesť alebo plnosť, perforácia hrubého čreva alebo blokády hrubého čreva alebo blízkych štruktúr. Po druhé, ako rakovina rastie, začína proces metastázovania, vypúšťanie tisícok buniek denne do krvi a lymfatického systému, čo môže spôsobiť vznik rakoviny na vzdialených miestach. Kolorektálne karcinómy sa najčastejšie šíria najskôr do miestnych lymfatických uzlín pred cestou do vzdialených orgánov. Akonáhle sú postihnuté lokálne lymfatické uzliny, šírenie do pečene, brušnej dutiny a pľúc sú ďalšími najčastejšími cieľmi metastatického šírenia.
Kolorektálny karcinóm je treťou najčastejšou príčinou rakoviny v USA u mužov aj žien. Ročne postihuje viac ako 135 000 ľudí, čo predstavuje 8 % všetkých druhov rakoviny. Približne 4,3 % ľudí bude v určitom okamihu života diagnostikovaných s rakovinou hrubého čreva alebo konečníka.
Kliknutím na tlačidlo Odoslať súhlasím so zmluvnými podmienkami a zásadami ochrany osobných údajov MedicineNet. Tiež súhlasím s prijímaním e-mailov od MedicineNet a beriem na vedomie, že sa môžem kedykoľvek odhlásiť z odberu MedicineNet.
Zdravotnícki pracovníci sú si istí, že kolorektálny karcinóm nie je nákazlivý (človek nemôže dostať chorobu od onkologického pacienta). Niektorí ľudia majú väčšiu pravdepodobnosť vzniku kolorektálneho karcinómu ako iní. Medzi faktory, ktoré zvyšujú riziko rakoviny hrubého čreva a konečníka, patrí zvyšujúci sa vek, afroamerická rasa, vysoký príjem tukov, rodinná anamnéza kolorektálneho karcinómu a polypov, prítomnosť polypov v hrubom čreve a zápalové ochorenia čriev, predovšetkým chronická ulcerózna kolitída.
Zvyšujúci sa vek je hlavným rizikovým faktorom kolorektálneho karcinómu. Približne 90 % kolorektálneho karcinómu je diagnostikovaných po 50. roku života.
Afroameričania majú vyšší výskyt kolorektálneho karcinómu ako ľudia iných rás.
Mnohé výskumné štúdie preukázali, že diéty s vysokým obsahom tuku predisponujú ľudí k rakovine hrubého čreva a konečníka. V krajinách s vysokou mierou rakoviny hrubého čreva a konečníka je príjem tukov v populácii oveľa vyšší ako v krajinách s nízkou mierou rakoviny. Predpokladá sa, že trávenie tuku, ku ktorému dochádza v tenkom čreve a hrubom čreve, vedie k tvorbe rakovinotvorných chemikálií (karcinogénov). Výskumné štúdie tiež odhaľujú, že strava s vysokým obsahom zeleniny a potravín s vysokým obsahom vlákniny, ako sú celozrnné pečivo a cereálie, obsahuje menej tuku, ktorý produkuje tieto karcinogény a môže pôsobiť proti účinkom karcinogénov. Oba účinky by pomohli znížiť riziko rakoviny.
Výskum ukázal, že väčšina kolorektálnych karcinómov sa vyvíja v kolorektálnych polypoch. Preto odstránenie nezhubných (ale prekanceróznych) kolorektálnych polypov môže zabrániť rakovine hrubého čreva a konečníka. Prekancerózne kolorektálne polypy sa najčastejšie nazývajú adenomatózne polypy. Vyvíjajú sa, keď dôjde k poškodeniu chromozómov v bunkách vnútornej výstelky hrubého čreva. Poškodenie produkuje abnormálne bunky, ale bunky si ešte nevyvinuli schopnosť šíriť sa, čo je charakteristický znak rakoviny. Namiesto toho rastúce tkanivo zostáva lokalizované v polype. Keď sa chromozomálne poškodenie v polype ďalej zvyšuje, rast buniek sa stáva nekontrolovateľným a bunky sa začínajú šíriť, to znamená, že sa stanú rakovinou. Polypy hrubého čreva, ktoré sú pôvodne benígne, teda získajú ďalšie poškodenie chromozómov, aby sa stali rakovinovými.
Chronická ulcerózna kolitída spôsobuje zápal vnútornej výstelky hrubého čreva. Rakovina čreva je uznávanou komplikáciou chronickej ulceróznej kolitídy. Riziko rakoviny sa začína zvyšovať po 8 až 10 rokoch kolitídy. Riziko vzniku rakoviny hrubého čreva u pacienta s ulceróznou kolitídou tiež súvisí s lokalizáciou a rozsahom jeho ochorenia.
Pacienti s vyšším rizikom rakoviny sú pacienti s rodinnou anamnézou rakoviny hrubého čreva, dlhotrvajúcou ulceróznou kolitídou, rozsiahlym postihnutím hrubého čreva ulceróznou kolitídou a pacienti s ochorením pečene súvisiacim s ulceróznou kolitídou, sklerotizujúcou cholangitídou.
Keďže rakoviny spojené s ulceróznou kolitídou majú priaznivejší výsledok, keď sa zachytia v skoršom štádiu, často sa po ôsmich rokoch známeho rozsiahleho ochorenia odporúčajú každoročné vyšetrenia hrubého čreva. Počas týchto vyšetrení sa odoberajú vzorky tkaniva (biopsie), aby sa pátrali po prekanceróznych zmenách v bunkách, ktoré lemujú hrubé črevo. Keď sa zistia prekancerózne zmeny, môže byť potrebné odstránenie celého hrubého čreva, aby sa zabránilo rakovine hrubého čreva.
Genetické pozadie človeka je dôležitým faktorom rizika rakoviny hrubého čreva. Mať príbuzného prvého stupňa s rakovinou hrubého čreva, najmä ak bola rakovina diagnostikovaná pred dosiahnutím veku 55 rokov, zhruba zdvojnásobuje riziko vzniku tohto ochorenia.
Napriek tomu, že rodinná anamnéza rakoviny hrubého čreva je dôležitým rizikovým faktorom, väčšina (80 %) rakoviny hrubého čreva sa vyskytuje sporadicky u pacientov bez rodinnej anamnézy rakoviny hrubého čreva. Približne 20 % prípadov rakoviny je spojených s rodinnou anamnézou rakoviny hrubého čreva.
Chromozómy obsahujú genetickú informáciu a poškodenie chromozómov spôsobuje genetické defekty, ktoré vedú k tvorbe polypov hrubého čreva a neskôr k rakovine hrubého čreva. Pri sporadických polypoch a rakovinách (polypy a rakoviny, ktoré sa vyvinú bez rodinnej anamnézy) sa získajú chromozómové poškodenia (vyvinú sa v bunke počas dospelosti). Poškodené chromozómy možno nájsť iba v polypoch a rakovinách, ktoré sa z tejto bunky vyvinú. Ale pri dedičných syndrómoch rakoviny hrubého čreva sú chromozomálne chyby zdedené pri narodení a sú prítomné v každej bunke v tele. Pacienti, ktorí zdedili gény dedičného syndrómu rakoviny hrubého čreva, sú vystavení riziku vzniku polypov hrubého čreva, zvyčajne v mladom veku, a majú veľmi vysoké riziko vzniku rakoviny hrubého čreva v ranom veku; sú tiež vystavení riziku vzniku rakoviny v iných orgánoch.
Familiárna adenomatózna polypóza (FAP) je jeden dedičný syndróm kolorektálneho karcinómu, pri ktorom sa u postihnutých členov rodiny vyvinie nespočetné množstvo (stovky, niekedy tisíce) polypov hrubého čreva počnúc ich tínedžerstvom. Pokiaľ sa tento stav nezistí a nelieči včas (liečba zahŕňa odstránenie hrubého čreva), u osoby postihnutej FAP je takmer isté, že z týchto polypov vznikne rakovina hrubého čreva. Rakovina sa takmer určite vyvinie v čase, keď má človek 40 rokov. Títo pacienti sú tiež vystavení riziku vzniku iných druhov rakoviny, ako je rakovina štítnej žľazy, žalúdka a ampulky (časť žlčovodu, kde odteká z pečene do tenkého čreva), ako aj nezhubné nádory nazývané desmoidné nádory. FAP vzniká mutáciou v špecifickom géne nazývanom APC gén. Špecifickú mutáciu možno u väčšiny ľudí identifikovať pomocou vhodného testovania a takéto testovanie sa odporúča jednotlivcom s diagnózou FAP, ako aj ich rodinným príslušníkom.
Atenuovaná familiárna adenomatózna polypóza (AFAP) je miernejšia verzia FAP. U postihnutých členov sa vyvinie menej ako 100 polypov hrubého čreva. Napriek tomu je u nich stále veľmi vysoké riziko vzniku rakoviny hrubého čreva v mladom veku. Hrozí im tiež, že budú mať polypy žalúdka a dvanástnikové polypy.
Dedičná nepolypózna rakovina hrubého čreva (známa aj ako Lynchov syndróm alebo HNPCC) je dedičný syndróm kolorektálneho karcinómu, pri ktorom sa u členov rodiny môžu vyvinúť polypy a rakovina hrubého čreva, zvyčajne v pravom hrubom čreve, vo veku 30 až 40 rokov. Pacienti s HNPCC sú tiež vystavení riziku vzniku rakoviny maternice, rakoviny žalúdka, rakoviny vaječníkov a rakoviny močovodov (trubice, ktoré spájajú obličky s močovým mechúrom) a žlčových ciest. Iróniou osudu sa zdá, že zatiaľ čo rakovina hrubého čreva sa u pacientov s HNPCC vyskytuje častejšie, tieto rakoviny sa dajú ľahšie vyliečiť ako „sporadické“ rakoviny hrubého čreva. Boli identifikované špecifické genetické abnormality spojené s HNPCC a pacienti a rodinní príslušníci môžu byť testovaní, aby sa zistilo, či je prítomný HNPCC a či členovia rodiny nesú abnormalitu a je pravdepodobné, že sa u nich vyvinie rakovina.
MYH polypózny syndróm je nedávno objavený dedičný syndróm kolorektálneho karcinómu. U postihnutých členov sa vo veku okolo 40 rokov zvyčajne vyvinie 10 až 100 polypov a sú vystavení vysokému riziku vzniku rakoviny hrubého čreva. Aj tu bola identifikovaná genetická abnormalita.
Je dôležité si uvedomiť, že prevažná väčšina kolorektálnych karcinómov nemá jedinú identifikovateľnú chromozomálnu abnormalitu, ktorú by bolo možné hľadať u príbuzných, aby bolo možné identifikovať jedincov s rizikom kolorektálneho karcinómu.
Symptómy súvisiace s kolorektálnym karcinómom sú početné a nešpecifické. Zahŕňajú únavu, slabosť, dýchavičnosť, zmenu vo vyprázdňovaní, úzku stolicu, hnačku alebo zápchu, červenú alebo tmavú krv v stolici, chudnutie, bolesti brucha, kŕče alebo nadúvanie. Iné stavy, ako je syndróm dráždivého čreva (spastické hrubé črevo), ulcerózna kolitída, Crohnova choroba, divertikulóza a peptický vred, môžu mať príznaky, ktoré napodobňujú rakovinu čreva.
Kolorektálny karcinóm môže byť prítomný niekoľko rokov, kým sa rozvinú symptómy. Príznaky sa líšia podľa toho, kde v hrubom čreve sa nádor nachádza. Pravé hrubé črevo je širšie a pružnejšie. Dokonca sa dá nazvať relatívne priestranným v porovnaní so zvyškom hrubého čreva. Rakoviny pravého hrubého čreva môžu narásť do veľkých rozmerov skôr, ako spôsobia akékoľvek brušné príznaky. Pravostranné rakoviny zvyčajne spôsobujú anémiu nedostatku železa v dôsledku pomalej straty krvi počas dlhého časového obdobia. Anémia spôsobená nedostatkom železa spôsobuje únavu, slabosť a dýchavičnosť. Ľavé hrubé črevo je užšie ako pravé hrubé črevo. Preto je pravdepodobnejšie, že rakovina ľavého hrubého čreva spôsobí čiastočnú alebo úplnú obštrukciu čreva. Rakoviny spôsobujúce čiastočnú obštrukciu čriev môžu spôsobiť príznaky zápchy, zúženú stolicu, hnačku, bolesti brucha, kŕče a nadúvanie. Jasne červená krv v stolici môže tiež naznačovať rast blízko konca ľavého hrubého čreva alebo konečníka.
Pri podozrení na rakovinu hrubého čreva sa zvyčajne vykoná kolonoskopia na potvrdenie diagnózy a lokalizáciu nádoru.
Kolonoskopia je postup, pri ktorom zdravotnícky pracovník zavedie do konečníka dlhú ohybnú trubicu na kontrolu vnútra celého hrubého čreva. Kolonoskopia sa vo všeobecnosti považuje za presnejšiu ako röntgenové lúče s báriovým klystírom, najmä pri detekcii malých polypov. Ak sa zistia polypy hrubého čreva, zvyčajne sa odstránia kolonoskopom a pošlú sa patológovi. Patológ skúma polypy pod mikroskopom, aby skontroloval rakovinu. Kolonoskopia je najlepší postup pri podozrení na rakovinu hrubého čreva. Zatiaľ čo väčšina polypov odstránených kolonoskopom je benígna, mnohé sú prekancerózne. Odstránenie prekanceróznych polypov zabraňuje budúcemu rozvoju rakoviny hrubého čreva z týchto polypov.
Sigmoidoskopia je postup vykonávaný s použitím kratšieho flexibilného rozsahu na vyšetrenie len ľavého hrubého čreva a konečníka. Pripravuje sa a vykonáva sa ľahšie ako kompletná kolonoskopia, ale má zjavné obmedzenia v tom, že nie je dostatočne dlhá na posúdenie pravého aj priečneho hrubého čreva. Odstránenie polypu a rakovinová biopsia sa môže vykonať pomocou sigmoidoskopu.
Ak sa počas kolonoskopie zistia rakovinové výrastky, je možné získať malé vzorky tkaniva (biopsie) a preskúmať ich pod mikroskopom, aby sa zistilo, či je polyp rakovinový. Ak sa rakovina hrubého čreva potvrdí biopsiou, vykonajú sa stagingové vyšetrenia, aby sa zistilo, či sa rakovina už nerozšírila do iných orgánov. Keďže kolorektálny karcinóm má tendenciu šíriť sa do pľúc a pečene, stagingové testy zvyčajne zahŕňajú CT vyšetrenie pľúc, pečene a brucha. Skenovanie pozitrónovou emisnou tomografiou (PET), novší test, ktorý hľadá zvýšenú metabolickú aktivitu, ktorá je bežná v rakovinovom tkanive, sa tiež často používa na zistenie šírenia rakoviny hrubého čreva do lymfatických uzlín alebo iných orgánov.
Niekedy môže zdravotnícky pracovník získať krvný test "nádorového markera" nazývaný karcinoembryonálny antigén (CEA), ak existuje podozrenie na rakovinu. CEA je látka produkovaná niektorými bunkami rakoviny hrubého čreva a konečníka, ako aj niektorými inými typmi rakoviny. Niekedy sa vyskytuje vo vysokých hladinách u pacientov s kolorektálnym karcinómom, najmä keď sa choroba rozšírila. Môže slúžiť ako užitočný test, ktorý treba nasledovať, ak sa zistí, že je zvýšená pred odstránením rakoviny. Nie všetci pacienti s kolorektálnym karcinómom však budú mať zvýšenú CEA, aj keď sa ich rakovina rozšírila. (Niektoré kolorektálne karcinómy ho nevytvárajú.) Navyše niektorí pacienti bez rakovina môže mať zvýšený krvný test CEA. Napríklad asi 15 % fajčiarov bude mať zvýšenú CEA bez rakoviny hrubého čreva. CEA sa teda nepoužíva na diagnostiku kolorektálneho karcinómu, ale skôr na sledovanie účinkov liečby kolorektálneho karcinómu u niekoho so známou anamnézou ochorenia, pretože opäť u niektorých pacientov množstvo rakovinového tkaniva koreluje s úrovňou CEA.
Keď sa diagnostikuje kolorektálny karcinóm, vykonajú sa ďalšie testy na určenie rozsahu ochorenia. Tento proces sa nazýva inscenácia. Staging určuje, ako pokročilý sa stal kolorektálny karcinóm. Štádium kolorektálneho karcinómu sa pohybuje od štádia I, najmenej pokročilého karcinómu, po štádium IV, najpokročilejšieho karcinómu.
S každým ďalším štádiom rakoviny hrubého čreva sa zvyšuje riziko recidívy rakoviny a smrti v dôsledku šírenia rakoviny (metastázy). Ako bolo uvedené, skoršie rakoviny majú nižšie riziko recidívy a smrti. V čase, keď má jednotlivec štvrté štádium kolorektálneho karcinómu, je prognóza zlá. Avšak aj v štádiu IV kolorektálneho karcinómu (v závislosti od toho, kde sa rakovina rozšírila) existuje príležitosť na vyliečenie.
Chirurgia je najbežnejšou počiatočnou liečbou rakoviny hrubého čreva a konečníka. Počas operácie sa odstráni nádor, malý okraj okolitého zdravého čreva a priľahlé lymfatické uzliny. Chirurg potom znovu spojí zdravé časti čreva. U pacientov s rakovinou konečníka sa konečník niekedy natrvalo odstráni, ak rakovina vznikne príliš nízko v konečníku. Chirurg potom vytvorí na brušnej stene otvor (kolostómiu), cez ktorý sa vylučuje tuhý odpad z hrubého čreva. Špeciálne vyškolené sestry (enterostomálne terapeutky) môžu pomôcť pacientom prispôsobiť sa kolostómii a väčšina pacientov s kolostómiami sa vráti k normálnemu životnému štýlu.
V prípade včasnej rakoviny čreva je odporúčanou liečbou chirurgické odstránenie. Pre väčšinu ľudí s rakovinou hrubého čreva v počiatočnom štádiu (štádium I a väčšina štádia II) je jedinou potrebnou liečbou samotný chirurgický zákrok. Chemoterapia môže byť ponúknutá niektorým ľuďom s rakovinou štádia II, ktorí majú faktory naznačujúce, že ich nádor môže mať vyššie riziko recidívy. Keď sa však rakovina hrubého čreva rozšíri do miestnych lymfatických uzlín (štádium III), riziko návratu rakoviny zostáva vysoké, aj keď chirurg odstráni všetky viditeľné dôkazy rakoviny. Je to kvôli zvýšenej pravdepodobnosti, že drobné rakovinové bunky mohli uniknúť pred operáciou a sú príliš malé na to, aby sa v tom čase dali zistiť krvnými testami, skenmi alebo dokonca priamym vyšetrením. Ich prítomnosť sa odvodzuje od vyššieho rizika neskoršej recidívy rakoviny hrubého čreva (recidívy). Lekárski onkologickí lekári (lekári onkológovia) odporúčajú v tomto prostredí ďalšiu liečbu rakoviny hrubého čreva s chemoterapiou, aby sa znížilo riziko návratu rakoviny. Lieky používané na chemoterapiu vstupujú do krvného obehu a útočia na všetky bunky rakoviny hrubého čreva, ktoré sa pred operáciou vyliali do krvi alebo lymfatického systému, a pokúšajú sa ich zabiť skôr, ako sa dostanú do obchodu s inými orgánmi. Ukázalo sa, že táto stratégia, nazývaná adjuvantná chemoterapia, znižuje riziko recidívy rakoviny a odporúča sa všetkým pacientom s rakovinou hrubého čreva štádia III, ktorí sú dostatočne zdraví na to, aby ju podstúpili, ako aj niektorým pacientom s vyšším rizikom štádia II, ktorých nádor môže mať zistilo sa, že pred operáciou upchali alebo prederavili stenu čreva.
Existuje niekoľko rôznych možností adjuvantnej chemoterapie na liečbu rakoviny hrubého čreva. Liečba zahŕňa kombináciu chemoterapeutických liekov podávaných perorálne alebo do žíl. Liečba sa zvyčajne podáva celkovo šesť mesiacov. Je dôležité stretnúť sa s onkológom, ktorý môže vysvetliť možnosti adjuvantnej chemoterapie, ako aj vedľajšie účinky, na ktoré si treba dávať pozor, aby bolo možné urobiť správnu voľbu pre pacienta ako jednotlivca.
Chemoterapia sa zvyčajne podáva na klinike zdravotníckeho pracovníka, v nemocnici ako ambulantný pacient alebo doma. Chemoterapia sa zvyčajne podáva v cykloch liečby, po ktorých nasledujú obdobia zotavenia bez liečby. Vedľajšie účinky chemoterapie sa líšia od človeka k človeku a tiež závisia od podávaných látok. Moderné chemoterapeutické činidlá sú zvyčajne dobre tolerované a vedľajšie účinky u väčšiny ľudí sú zvládnuteľné. Vo všeobecnosti protirakovinové lieky ničia bunky, ktoré rýchlo rastú a delia sa. Preto môžu byť normálne červené krvinky, krvné doštičky a biele krvinky, ktoré tiež rýchlo rastú, ovplyvnené chemoterapiou. V dôsledku toho medzi časté vedľajšie účinky patrí anémia, strata energie a nízka odolnosť voči infekciám. Bunky vo vlasových korienkoch a črevách sa tiež rýchlo delia. Preto môže chemoterapia spôsobiť vypadávanie vlasov, vredy v ústach, nevoľnosť, vracanie a hnačku, ale tieto účinky sú prechodné.
Akonáhle sa rakovina hrubého čreva a konečníka rozšíri ďaleko od miesta primárneho nádoru, je opísaná ako ochorenie v štádiu IV. Tieto vzdialené ložiská nádoru, ktoré sa vylúčili z primárneho nádoru, prešli krvným alebo lymfatickým systémom a vytvorili nové nádory v iných orgánoch. V tomto bode už rakovina hrubého čreva a konečníka nie je lokálnym problémom, ale namiesto toho ide o systémový problém s rakovinovými bunkami, ktoré sú viditeľné na skenovaní aj nedetegovateľné, ale pravdepodobne sú prítomné inde v tele. V dôsledku toho je vo väčšine prípadov najlepšou liečbou chemoterapia, čo je systémová liečba. Chemoterapia metastatického kolorektálneho karcinómu preukázateľne predlžuje život a zlepšuje kvalitu života. Pri dobrej liečbe sú vedľajšie účinky chemoterapie zvyčajne oveľa menšie ako vedľajšie účinky nekontrolovanej rakoviny. Chemoterapia samotná nemôže vyliečiť metastatickú rakovinu hrubého čreva, ale môže viac ako zdvojnásobiť očakávanú dĺžku života a umožniť dobrú kvalitu života počas liečby.
Možnosti chemoterapie na liečbu kolorektálneho karcinómu sa líšia v závislosti od iných zdravotných problémov, ktorým jednotlivec čelí. Pre zdatnejších jedincov sa zvyčajne odporúčajú kombinácie niekoľkých chemoterapeutických liekov, zatiaľ čo pre chorých ľudí môže byť najlepšia jednoduchšia liečba. Rôzne režimy s viacerými liekmi kombinujú látky s preukázanou aktivitou pri kolorektálnom karcinóme, ako je 5-fluóruracil (5-FU), ktorý sa často podáva s liekom leukovorínom (nazývaným aj kyselina folínová) alebo podobným liekom nazývaným levoleukovorín, ktorý mu pomáha lepšie fungovať.
Capecitabine (Xeloda) je chemoterapeutický liek podávaný vo forme tabliet. Keď sa dostane do tela, zmení sa na 5-FU, keď sa dostane do miesta nádoru. Ďalšie chemoterapeutické lieky na kolorektálny karcinóm sú irinotekan (Camptosar), oxaliplatina (Eloxatin) a trifluridín a tipiracil (Lonsurf), kombinované liečivo vo forme tabliet. Chemotherapy regimens often have acronyms to simplify their nomenclature (such as FOLFOX, FOLFIRI, and FLOX).
Targeted therapies are newer treatments that target specific aspects of the cancer cell, which may be more important to the tumor than the surrounding tissues, offering potentially effective treatments with fewer side effects than traditional chemotherapy. Bevacizumab (Avastin), cetuximab (Erbitux), panitumumab (Vectibix), ramucirumab (Cyramza), regorafenib (Stivarga), and ziv-aflibercept (Zaltrap) are targeted therapies that have been used in the management of advanced colorectal cancer. These newer chemotherapeutic agents most often are combined with standard chemotherapy to enhance their effectiveness.
If the first treatment is not effective, second- and third-line options are available that can confer a benefit to people living with colorectal cancer.
Radiation therapy is the primary treatment of colorectal cancer has been limited to treating cancer of the rectum. As noted earlier, whereas parts of the colon move freely within the abdominal cavity, the rectum is fixed in place within the pelvis. It is in an intimate relationship with many other structures and the pelvis is a more confined space. For these reasons, a tumor in the rectum often is harder to remove surgically because space is smaller and other structures can be involved with cancer. As a result, for all but the earliest rectal cancers, initial chemotherapy and radiation treatments (a local treatment to a defined area) are recommended to try and shrink cancer, allowing for easier removal and lowering the risk of cancer returning locally. Radiation therapy is typically given under the guidance of a radiation specialist called a radiation oncologist. Initially, individuals undergo a planning session, a complicated visit as the doctors and technicians determine exactly where to give the radiation and which structures to avoid. Chemotherapy usually is administered daily while the radiation is delivered. Side effects of radiation treatment include fatigue, temporary or permanent pelvic hair loss, and skin irritation in the treated areas.
Radiation therapy will occasionally be used as a palliative treatment to reduce pain from the recurrent or metastatic colon or rectal cancer.
Follow-up exams are important for people with colorectal cancer. The cancer can come back near the original site, although this is unusual. If the cancer returns, it typically does so in a distant location such as the lymph nodes, liver, or lungs. Individuals diagnosed with colorectal cancer remain at risk of their cancer returning for up to 10 years after their original diagnosis and treatment, although the risk of recurrence is much higher in the first few years. Medical providers in the United States follow patients with physical examinations and blood tests including the CEA (if it was elevated before surgery) tumor marker every three months for the first two years and then with decreasing frequency thereafter. Patients are also followed with colonoscopies (starting one year after their diagnosis) and with CT scans (typically performed at least once yearly for the first two to five years).
If a recurrence is noted either locally or with metastatic spread, individuals may still be treated with the intention of cure. For example, if a new tumor were to recur in the liver, individuals can be treated with a combination of chemotherapy and surgery (or sophisticated radiation techniques) in hopes of eradicating the cancer completely. Evaluation in hospitals of excellence that specialize in liver surgery can help guide these complicated treatment decisions and increase the chances of cure even in the setting of metastatic disease.
In addition to checking for cancer recurrence, patients who have had bowel cancer may have an increased risk of cancer of the prostate, breast, and ovary. Therefore, follow-up examinations in the clinic should include cancer screening for these diseases, as well.
Colorectal cancers are typically slow-growing cancers that take years to develop. Because they grow most often in a step-wise manner, screening can greatly reduce the likelihood of death associated with the disease. Whether with virtual colonoscopy or newer screening techniques, the future must focus first and foremost on better, more comprehensive screening programs that find polyps and early cancers before they become life-threatening. The public also must be educated on the value of screening programs.
For those living with cancer, intensive research is ongoing to better understand cancer biology and genetics so that specific approaches can be developed to attack specific types of cancers and, more importantly, specific individuals' cancers. Each person living with cancer has a disease with a unique biology and genetic code and the secret to better treatments involves unlocking that code. Cancer is very complex and scientists are just beginning to unravel its secrets. Progress is frustratingly slow for those battling the disease. With each passing year, however, our understanding increases and treatments become more refined. If you or your family member is living with colorectal cancer, speak with your doctor about ways you can participate in research through clinical trials to help increase our knowledge and improve our therapies for this difficult disease.
Survival rates for any cancer are often reported by stage, the extent of spread when the cancer is identified. For colon and rectum cancer, around 39% are diagnosed at the local stage, before the cancer has spread outside the local area. The five-year survival for these patients with localized colon and rectum cancer is around 90%.
When the cancer has spread to the regional lymph nodes near the site of origin, the five-year survival rate is about 71%. When the cancer has metastasized to distant sites in the body (stage IV cancer), the five-year survival rate lowers to about 14%.
The most effective prevention for colorectal cancer is early detection and removal of precancerous colorectal polyps before they turn cancerous. Even in cases where cancer has already developed, early detection still significantly improves the chances of a cure by surgically removing the cancer before the disease spreads to other organs.
Regular physical activity is associated with lower risk of colon cancer. Aspirin use also appears to lower the risk of bowel cancer. The use of combined estrogen and progestin in hormone replacement therapy lowers the risk of colon cancer in postmenopausal women. Hormone replacement therapy has risks which must be weighed against this effect, and should be discussed with a doctor.
Blood tests are now available to test for hereditary colon cancer syndromes. Families with multiple members having colon cancers, multiple colon polyps, cancers at young ages, and other cancers such as cancers of the ureters, uterus, duodenum, and more, may take advantage of resources such as genetic counseling, followed possibly by genetic testing. Genetic testing without prior counseling is discouraged because of the extensive family education that is involved and the complicated nature of interpreting the test results.
The advantages of genetic counseling followed by genetic testing include:(1) identifying family members at high risk of developing colon cancer to begin colonoscopies early; (2) identifying high-risk members so that screening may begin to prevent other cancers such as ultrasound tests for uterine cancer, urine examinations for ureter cancer, and upper endoscopies for stomach and duodenal cancers; and (3) alleviating concern for members who test negative for the hereditary genetic defects.
People can change their eating habits by reducing fat intake and increasing fiber (roughage) in their diet. Major sources of fat are meat, eggs, dairy products, salad dressings, and oils used in cooking. Fiber is the insoluble, nondigestible part of plant material present in fruits, vegetables, and whole-grain breads and cereals. It is postulated that high fiber in the diet leads to the creation of bulky stools which can rid the intestines of potential carcinogens. In addition, fiber leads to the more rapid transit of fecal material through the intestine, thus allowing less time for a potential carcinogen to react with the intestinal lining.
The term "screening" is properly applied only to the use of testing to look for evidence of cancer or pre-cancerous polyps in individuals who are asymptomatic and at only average risk for a type of cancer. Those patients who, for example, have a positive family history of colon cancer, or are symptomatic for a colon abnormality, undergo diagnostic testing rather than screening tests.
There are different types of screening tests for colorectal cancer:fecal (stool) occult blood testing, sigmoidoscopy, colonoscopy, digital colonoscopy, and DNA testing of the stool. The US Preventive Services Task Force (USPSTF) recommends strongly that screening begin at age 50 years for average-risk adults, but there is no specific recommendation for one screening test or strategy over another. The USPSTF advises that patients be offered a choice of screening options, using shared decision-making with the patient and physician to arrive at the best choice of screening programs for each individual.
Tumors of the colon and rectum tend to bleed slowly into the stool. The small amount of blood mixed into the stool usually is not visible to the naked eye. The commonly used stool occult blood tests rely on chemical color conversions to detect microscopic amounts of blood. These tests are both convenient and inexpensive. There are two kinds of fecal occult blood tests. The first is known as a guaiac FOBT. In this test, a small amount of stool is smeared on a special card for occult blood testing when a chemical is added to the card. Usually, three consecutive stool cards are collected. The other type of FOBT is an immunochemical test in which a special solution is added to the stool sample and analyzed in the laboratory using antibodies that can detect blood in a stool sample. The immunochemical test is a quantitative test that is more sensitive and specific for the diagnosis of polyps and cancer. It is preferred over the guaiac test.
A person who tests positive for stool occult blood has a 30%-45% chance of having a colon polyp and a 3%-5% chance of having a colon cancer. Colon cancers found under these circumstances tend to be small and not to have spread and have a better long-term prognosis.
It is important to remember that having stool tested positive for occult blood does not necessarily mean a person has colon cancer. Many other conditions can cause occult blood in the stool. However, patients with a positive stool occult blood test should undergo further evaluations to exclude colon cancer and to explain the source of the bleeding. It is also important to realize that stool that has tested negative for occult blood does not mean that colorectal cancer or polyps do not exist. Even under ideal testing conditions, a significant percentage of colon cancers can be missed by stool occult blood screening. Many patients with colon polyps do not have positive stool occult blood. In patients suspected of having colorectal polyps and in those at higher risk for developing colorectal polyps and cancer, screening flexible sigmoidoscopies or colonoscopies are performed even if the FOBT is negative.
Flexible sigmoidoscopy is an exam of the rectum and the lower colon (60 cm or about 2 feet in from the outside) using a viewing tube (a short version of colonoscopy). Research studies have shown that the use of screening flexible sigmoidoscopy can reduce mortality from colon cancer. This is a result of the detection of polyps or early cancers in people with no symptoms. If a polyp or cancer is found, a complete colonoscopy is recommended. The majority of colon polyps can be completely removed at the time of colonoscopy without surgery; however, polyps in the proximal colon that cannot be reached by the sigmoidoscope will be missed. Flexible sigmoidoscopy is often combined with fecal occult blood testing for colorectal cancer screening.
Colonoscopy uses a long (120 cm-150 cm) flexible tube, which can examine the entire length of the colon. Through this tube, the doctor (typically a gastroenterologist) can both view and take pictures of the entire colon and also can take biopsies of colon masses and remove polyps.
Patients with a high risk of developing colorectal cancer may undergo screening colonoscopies starting at earlier ages than 50. For example, patients with a family history of colon cancer are recommended to start screening colonoscopies at an age 10 years before the earliest colon cancer diagnosed in a first-degree relative or five years earlier than the earliest precancerous colon polyp discovered in a first-degree relative. Patients with hereditary colon cancer syndromes such as FAP, AFAP, HNPCC, and MYH are recommended to begin colonoscopies early. The recommendations differ depending on the genetic defect. For example, in people with FAP, colonoscopies may begin during teenage years to look for the development of colon polyps. Patients with a prior history of polyps or colon cancer may also undergo colonoscopies to exclude recurrence. Patients with a long history (greater than 10 years) of chronic ulcerative colitis have an increased risk of colon cancer and should have regular colonoscopies to look for precancerous changes in the colon lining.
Virtual colonoscopy (computerized tomographic or CT colonography) has been utilized in the clinic as a screening technique for colorectal cancer. Virtual colonoscopy employs a CT scan using low doses of radiation with special software to visualize the inside of the colon and look for polyps or masses. The procedure typically involves a bowel preparation with laxatives and/or enemas (although not always) followed by a CT scan after air is introduced into the colon. Because no sedation is necessary, individuals can return to work or other activities upon completion of the test. Virtual colonoscopies appear to be equally able to detect larger polyps (over 1 centimeter in size) as regular colonoscopies. The virtual colonoscopy cannot be used to biopsy or remove tissue from the colon. A follow-up sigmoidoscopy or colonoscopy must be done to accomplish that.
The Cologuard test is available in the U.S. for in-home sample collection for adults over 50 at average risk for colon cancer. The sample is sent to a laboratory for analysis of DNA changes in DNA from cells shed by the intestinal lining into the stool or hemoglobin in the sample. In a research study, the test was able to find 92% of colon cancers and 69% of precancers of the colon. False-negative and false-positive results are also possible.
 Spôsoby, ako pomôcť svojmu dieťaťu osvojiť si správne stravovacie návyky
Spôsoby, ako pomôcť svojmu dieťaťu osvojiť si správne stravovacie návyky
 Rakovina pažeráka:čo to je?
Rakovina pažeráka:čo to je?
 Najzdravšie črevné baktérie s rastlinnou alebo stredomorskou stravou
Najzdravšie črevné baktérie s rastlinnou alebo stredomorskou stravou
 Časť 4:Znovuzavedenie stravy po elementárnej diéte
Časť 4:Znovuzavedenie stravy po elementárnej diéte
 Výživa pri mikroskopickej kolitíde
Výživa pri mikroskopickej kolitíde
 Ako prekonať kožné problémy, depresiu a nízku energiu
Ako prekonať kožné problémy, depresiu a nízku energiu
 Mohli by sviatky spustiť váš kyslý reflux?
Zatiaľ čo sviatky majú byť veselé a svetlé, v skutočnosti môžu mať na ľudí opačný vplyv. Prázdniny môžu byť stresujúce. Tlak na získavanie darčekov, svokrovcov a pracovné funkcie na vás tento mesiac m
Mohli by sviatky spustiť váš kyslý reflux?
Zatiaľ čo sviatky majú byť veselé a svetlé, v skutočnosti môžu mať na ľudí opačný vplyv. Prázdniny môžu byť stresujúce. Tlak na získavanie darčekov, svokrovcov a pracovné funkcie na vás tento mesiac m
 Bezlepková diéta Amy s celiakiou nepomohla, ale tu je to, čo pomohlo
Máte pocit, že vaše tráviace symptómy vám bránia v plnení vášho potenciálu? Viem, že som sa tak cítil, keď som bol naozaj chorý. Či už som mal problémy so svojím šéfom, pretože som OPÄŤ uviazol v kú
Bezlepková diéta Amy s celiakiou nepomohla, ale tu je to, čo pomohlo
Máte pocit, že vaše tráviace symptómy vám bránia v plnení vášho potenciálu? Viem, že som sa tak cítil, keď som bol naozaj chorý. Či už som mal problémy so svojím šéfom, pretože som OPÄŤ uviazol v kú
 Najlepší SIBO diétny plán:čo potrebujete vedieť
. Takže vám bol diagnostikovaný bakteriálny prerastanie tenkého čreva (SIBO) a bolo vám povedané, že musíte dodržiavať diétny plán SIBO. Akú diétu si však zvoliť a ako dlho ju dodržiavať? Dnes si p
Najlepší SIBO diétny plán:čo potrebujete vedieť
. Takže vám bol diagnostikovaný bakteriálny prerastanie tenkého čreva (SIBO) a bolo vám povedané, že musíte dodržiavať diétny plán SIBO. Akú diétu si však zvoliť a ako dlho ju dodržiavať? Dnes si p