 Rak debelega črevesa je tretji vodilni vzrok raka v ZDA
Rak debelega črevesa je tretji vodilni vzrok raka v ZDAZnaki in simptomi raka debelega črevesa običajno niso specifični. Z drugimi besedami, znaki in simptomi se lahko pojavijo zaradi številnih različnih stanj. Ko se rak debelega črevesa odkrije v zgodnjih fazah, morda niti ni povzročil simptomov. Simptomi se lahko razlikujejo tudi glede na specifično lokacijo v debelem črevesu, kjer se nahaja tumor.
Nekateri simptomi in znaki raka debelega črevesa so:

Vsak dan v naših telesih poteka ogromen proces uničenja in popravljanja. Človeško telo je sestavljeno iz približno 15 trilijonov celice in vsak dan milijarde celic se obrabijo ali uničijo. V večini primerov telo vsakič, ko je celica uničena, naredi novo celico, da jo nadomesti, pri čemer poskuša narediti celico, ki je popolna kopija celice, ki je bila uničena, ker mora biti nadomestna celica sposobna opravljati isto funkcijo kot celica. uničena celica. Med zapletenim postopkom zamenjave celic pride do številnih napak. Kljub izjemno elegantnim sistemom za preprečevanje napak, telo še vedno naredi na deset tisoče napak na dan pri zamenjavi celic, bodisi zaradi naključnih napak bodisi zaradi zunanjih pritiskov na postopek zamenjave, ki spodbujajo napake. Večino teh napak popravijo dodatni elegantni sistemi ali pa napaka privede do smrti na novo izdelane celice in nastane še ena normalna nova celica. Včasih pa se naredi napaka, ki se ne popravi. Številne nepopravljene napake imajo le malo vpliva na zdravje, a če napaka omogoči, da se na novo narejena celica deli neodvisno od nadzora in ravnotežja, ki nadzoruje normalno rast celic, se lahko ta celica začne nenadzorovano razmnoževati. Ko se to zgodi, se lahko razvije tumor (v bistvu množica nenormalnih celic).
Tumorji so razdeljeni v dve kategoriji:obstajajo benigni (nekancerozni) tumorji in maligni (rakavi) tumorji. Kakšna je torej razlika? Odgovor je, da benigni tumor raste le v tkivu, iz katerega nastane. Benigni tumorji lahko včasih zrastejo precej velike ali hitro in povzročijo hude simptome, celo smrt, čeprav večina ne. Na primer, fibroidni tumor v ženski maternici je vrsta benignega tumorja. Lahko povzroči krvavitev ali bolečino, vendar nikoli ne bo potoval izven maternice in ne bo rasel kot nov tumor drugje. Fibroidi, tako kot vsi benigni tumorji, nimajo zmožnosti odvajanja celic v krvni in limfni sistem, zato ne morejo potovati na druga mesta v telesu in rasti. Po drugi strani lahko rak izloči celice, ki lahko potujejo po krvi ali limfnem sistemu, pristanejo v tkivih, oddaljenih od primarnega tumorja, in prerastejo v nove tumorje v teh oddaljenih tkivih. Ta proces širjenja v oddaljena tkiva, imenovan metastaze, je odločilna značilnost rakavega ali malignega tumorja.
Benigne tumorske celice so pogosto videti razmeroma normalne, če jih pregledamo pod mikroskopom. Maligne ali rakave celice so običajno videti bolj nenormalne, če jih podobno gledamo pod mikroskopom.
Rak je skupina več kot 100 različnih bolezni, podobno kot nalezljive bolezni. Raki so poimenovani po tkivih, iz katerih nastane prvi tumor. Zato pljučni rak, ki potuje v jetra, ni rak na jetrih, ampak je opisan kot pljučni rak, ki metastazira v jetra, rak dojke, ki se razširi v možgane, pa ni opisan kot možganski tumor, temveč kot rak dojke, ki metastazira v možgani. Vsak rak je drugačna bolezen z različnimi možnostmi zdravljenja in različnimi napovedmi (verjetni izidi ali pričakovana življenjska doba). Pravzaprav ima vsak posameznik z rakom edinstveno bolezen in relativni uspeh ali pomanjkanje zdravljenja pri bolnikih z isto diagnozo je lahko zelo različen. Zato je pomembno, da vsako osebo z diagnozo raka obravnavamo kot posameznika, ne glede na vrsto raka.
 Slika raka debelega črevesa (kolorektalnega).
Slika raka debelega črevesa (kolorektalnega).
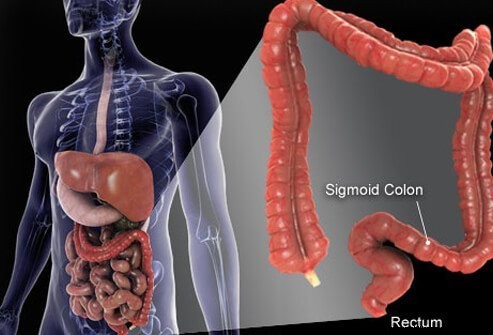
Debelo črevo in danka sta končna dela cevi, ki sega od ust do anusa. Hrana vstopi v usta, kjer jo prežvečijo in nato pogoltnejo. Nato potuje skozi požiralnik in v želodec. V želodcu se hrana zmelje na manjše delce in nato skrbno nadzorovano vstopi v tanko črevo. V tankem črevesu pride do končne prebave hrane in absorpcije hranil, ki jih vsebuje hrana. Hrana, ki se ne prebavi in absorbira, pride v debelo črevo (debelo črevo) in nazadnje v danko. Debelo črevo deluje predvsem kot skladišče odpadkov; vendar se dodatno odstranijo dodatna voda, soli in nekateri vitamini. Poleg tega nekatere neprebavljene hrane, na primer vlaknine, prebavijo bakterije debelega črevesa, nekateri produkti prebave pa se absorbirajo iz debelega črevesa v telo. (Ocenjuje se, da 10 % energije, pridobljene iz hrane, izvira iz teh produktov bakterijske prebave v debelem črevesu.) Preostala neprebavljena hrana, umirajoče celice iz črevesne sluznice in veliko število bakterij se shranijo v debelem črevesu in nato občasno prehaja v danko. Njihov prihod v danko sproži gibanje črevesja, ki izprazni vsebino debelega črevesa iz telesa kot blato.
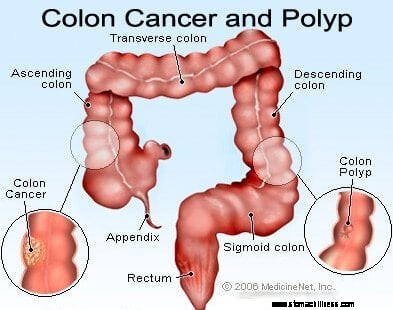
Čeprav je debelo črevo cev, je strukturno zapletena cev, bolj podobna radialni pnevmatiki z jeklenim pasom kot vrtni cevi. Cev je sestavljena iz štirih plasti. Prva je notranja plast celic, ki obdaja votlino, skozi katero potuje neprebavljena in prebavljiva hrana, imenovana sluznica. Sluznica je pritrjena na tanko drugo plast, submukozo, ki je pritrjena na plast mišice, muscularis. Celotna cev je obdana z vlaknastim (brazgotinastim) tkivom, imenovanim seroza. Najpogostejši rak debelega črevesa (vrsta, imenovan adenokarcinom) nastane iz sluznice, notranje plasti celic. Te celice so izpostavljene toksinom iz hrane in bakterij ter mehanski obrabi in se razmeroma hitro obračajo (odmirajo in se zamenjajo). Napake (običajno niz napak, ki vključujejo gene v nadomestnih celicah) vodijo do nenormalnih celic in nenadzorovane proliferacije nenormalnih celic, ki povzročajo raka. Hitra menjava omogoča več napak v primerjavi s tkivi, ki se ne obračajo tako hitro (na primer jetrno tkivo).
Večina debelega črevesa leži znotraj trebušne votline, imenovane peritonealna votlina. Deli debelega črevesa se lahko precej prosto gibljejo v peritonealni votlini, saj neprebavljena hrana prehaja skozi njo. Ko se debelo črevo usmeri proti danki, se pritrdi na tkiva za peritonealno votlino, območje, imenovano retroperitoneum. Končni del debelega črevesa, del, ki se nahaja v retroperitoneju, je rektum. Za razliko od večine preostalega debelega črevesa je danka pritrjena na mestu s tkivi, ki ga obdajajo. Zaradi svoje lokacije se zdravljenje raka danke pogosto razlikuje od zdravljenja raka preostalega debelega črevesa.
 Slika preseka debelega črevesa.
Slika preseka debelega črevesa. 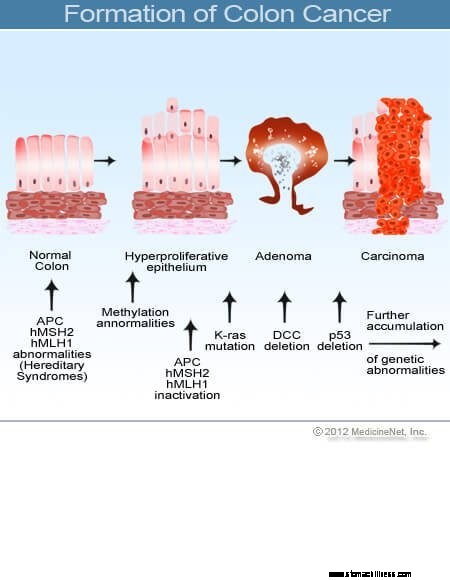 Slika nastanka raka debelega črevesa.
Slika nastanka raka debelega črevesa.
Človeško debelo črevo (debelo črevo) je dolgo približno 6 metrov.
Rak debelega črevesa in danke (kolorektalni rak) se začne, ko se proces normalne zamenjave celic sluznice debelega črevesa pokvari. Napake pri delitvi celic se pogosto pojavljajo. Zaradi slabo razumljenih razlogov včasih pride do napak, ki uidejo našim sistemom za urejanje. Ko se to zgodi, se te celice začnejo deliti neodvisno od običajnih nadzorov in ravnotežij, ki nadzorujejo rast. Ko te nenormalne celice rastejo in se delijo, lahko privedejo do rasti v debelem črevesu, imenovanih polipi. Polipi se razlikujejo po vrsti, vendar so mnogi predrakavi tumorji, ki rastejo počasi skozi leta in se ne širijo. Ko polipi rastejo, dodatne genetske mutacije še dodatno destabilizirajo celice. Ko ti predrakavi tumorji spremenijo smer (rastejo v steno cevi in ne v prostor na njeni sredini) in vdrejo v druge plasti debelega črevesa (kot je submukoza ali mišična plast), je predrakav polip postal rakast. V večini primerov je ta proces počasen in traja vsaj 8 do 10 let, da se razvije od teh zgodnjih aberantnih celic do odkritega raka. Rak debelega črevesa in danke je običajno adenokarcinom, izraz, ki se nanaša na raka, ki je nastal v določenih vrstah tkiv podloge v telesu.
Ko nastane kolorektalni rak, začne rasti na dva načina. Prvič, rak lahko raste lokalno in se razširi skozi steno črevesja ter vdre v sosednje strukture, zaradi česar je masa (imenovana primarni tumor) večja težava in jo je težje odstraniti. Lokalna razširitev lahko povzroči dodatne simptome, kot so bolečina ali polnost, perforacija debelega črevesa ali blokade debelega črevesa ali bližnjih struktur. Drugič, ko rak raste, se začne proces metastaz, pri čemer se na tisoče celic dnevno izloči v krvni in limfni sistem, kar lahko povzroči nastanek raka na oddaljenih lokacijah. Rak debelega črevesa in danke se najpogosteje najprej razširi na lokalne bezgavke, nato pa potuje v oddaljene organe. Ko so prizadete lokalne bezgavke, se razširijo na jetra, trebušno votlino in pljuča naslednja najpogostejša destinacija metastatskega širjenja.
Rak debelega črevesa in danke je tretji najpogostejši vzrok raka v ZDA tako pri moških kot pri ženskah. Letno prizadene več kot 135.000 ljudi, kar predstavlja 8 % vseh rakov. Približno 4,3 % ljudi bo kdaj v življenju zbolelo za rakom debelega črevesa ali danke.
S klikom na "Pošlji" se strinjam z določili in pogoji MedicineNet ter politiko zasebnosti. Strinjam se tudi s prejemanjem e-poštnih sporočil od MedicineNet in razumem, da se lahko kadar koli odjavim od naročnin na MedicineNet.
Zdravstveni delavci so prepričani, da rak debelega črevesa in danke ni nalezljiv (človek ne more prenesti bolezni pri bolniku z rakom). Nekateri ljudje imajo večjo verjetnost za razvoj kolorektalnega raka kot drugi. Dejavniki, ki povečajo tveganje za nastanek raka debelega črevesa in danke, vključujejo naraščajočo starost, afroameriško raso, visok vnos maščob, družinsko anamnezo kolorektalnega raka in polipov, prisotnost polipov v debelem črevesu in vnetne črevesne bolezni, predvsem kronični ulcerozni kolitis.
Starost je glavni dejavnik tveganja za kolorektalni rak. Približno 90 % raka debelega črevesa in danke se diagnosticira po 50. letu starosti.
Afroameričani imajo večjo incidenco raka debelega črevesa in danke kot ljudje drugih ras.
Številne raziskave so pokazale, da diete z visoko vsebnostjo maščob povzročajo nagnjenost ljudi k raku debelega črevesa in danke. V državah z visoko stopnjo raka debelega črevesa in danke je vnos maščob pri prebivalstvu veliko višji kot v državah z nizko stopnjo raka. Menijo, da prebava maščobe, ki se pojavi v tankem črevesu in debelem črevesu, vodi do tvorbe rakavih kemikalij (kancerogenov). Raziskovalne študije prav tako razkrivajo, da prehrana z veliko zelenjave in živil z visoko vsebnostjo vlaknin, kot so polnozrnati kruh in žitarice, vsebuje manj maščob, ki proizvajajo te rakotvorne snovi in lahko preprečijo učinke rakotvornih snovi. Oba učinka bi pomagala zmanjšati tveganje za raka.
Raziskave so pokazale, da se večina raka debelega črevesa in danke razvije v kolorektalnih polipih. Zato lahko odstranitev benignih (vendar predrakavih) kolorektalnih polipov prepreči kolorektalni rak. Predrakavi kolorektalni polipi se najpogosteje imenujejo adenomatozni polipi. Razvijejo se, ko pride do kromosomske poškodbe v celicah notranje sluznice debelega črevesa. Poškodba povzroči nenormalne celice, vendar celice še niso razvile sposobnosti širjenja, kar je znak raka. Namesto tega rastoče tkivo ostane lokalizirano znotraj polipa. Ko se kromosomska poškodba znotraj polipa še poveča, rast celic postane nenadzorovana in celice se začnejo širiti, kar pomeni, da postanejo rak. Tako polipi debelega črevesa, ki so sprva benigni, pridobijo dodatno poškodbo kromosomov, da postanejo rakavi.
Kronični ulcerozni kolitis povzroča vnetje notranje sluznice debelega črevesa. Rak črevesja je priznan zaplet kroničnega ulceroznega kolitisa. Tveganje za raka se začne povečevati po osmih do desetih letih kolitisa. Tveganje za razvoj raka debelega črevesa pri bolniku z ulceroznim kolitisom je povezano tudi z lokacijo in obsegom njegove bolezni.
Bolniki z večjim tveganjem za raka so tisti z družinsko anamnezo raka debelega črevesa, dolgotrajnim ulceroznim kolitisom, obsežno prizadetostjo debelega črevesa z ulceroznim kolitisom in tistimi z boleznijo jeter, povezano z ulceroznim kolitisom, sklerozirajočim holangitisom.
Ker imajo raka, povezane z ulceroznim kolitisom, ugodnejši izid, če jih odkrijejo v zgodnejši fazi, se po osmih letih znane obsežne bolezni pogosto priporočajo letni pregledi debelega črevesa. Med temi preiskavami se vzamejo vzorci tkiva (biopsije) za iskanje predrakavih sprememb v celicah, ki obdajajo debelo črevo. Ko se odkrijejo predrakave spremembe, bo morda potrebna odstranitev celotnega debelega črevesa za preprečevanje raka debelega črevesa.
Gensko ozadje osebe je pomemben dejavnik tveganja za nastanek raka debelega črevesa. Imeti sorodnika prve stopnje z rakom debelega črevesa in danke, še posebej, če je bil rak diagnosticiran pred 55. letom starosti, približno podvoji tveganje za razvoj bolezni.
Čeprav je družinska anamneza raka debelega črevesa pomemben dejavnik tveganja, se večina (80 %) raka debelega črevesa pojavlja sporadično pri bolnikih brez družinske anamneze raka debelega črevesa. Približno 20 % rakavih obolenj je povezanih z družinsko anamnezo raka debelega črevesa.
Kromosomi vsebujejo genetske informacije, kromosomske poškodbe pa povzročajo genetske okvare, ki vodijo v nastanek polipov debelega črevesa in kasneje raka debelega črevesa. Pri sporadičnih polipih in rakih (polipi in raki, ki se razvijejo brez družinske anamneze) se kromosomske poškodbe pridobijo (razvijejo v celici med odraslim življenjem). Poškodovane kromosome lahko najdemo le v polipih in rakih, ki se razvijejo iz te celice. Toda pri dednih sindromih raka debelega črevesa so kromosomske napake podedovane ob rojstvu in so prisotne v vsaki celici v telesu. Bolniki, ki so podedovali gene sindroma dednega raka debelega črevesa, so izpostavljeni tveganju za razvoj polipov debelega črevesa, običajno v mladosti, in imajo zelo veliko tveganje za razvoj raka debelega črevesa zgodaj v življenju; prav tako so izpostavljeni tveganju za razvoj raka na drugih organih.
Družinska adenomatozna polipoza (FAP) je en dedni sindrom kolorektalnega raka, pri katerem bodo prizadeti družinski člani razvili nešteto (na stotine, včasih na tisoče) polipov debelega črevesa, ki se začnejo v mladosti. Če se stanje ne odkrije in zdravi zgodaj (zdravljenje vključuje odstranitev debelega črevesa), bo oseba, ki jo prizadene FAP, skoraj zagotovo razvila raka debelega črevesa zaradi teh polipov. Rak se skoraj zagotovo razvije do takrat, ko je človek v 40-ih letih. Pri teh bolnikih obstaja tudi tveganje za razvoj drugih vrst raka, kot so rak ščitnice, želodca in ampule (del žolčevoda, kjer se iz jeter odteka v tanko črevo), kot tudi benigni tumorji, imenovani dezmoidni tumorji. FAP nastane zaradi mutacije v posebnem genu, imenovanem gen APC. Specifično mutacijo je pri večini ljudi mogoče prepoznati z ustreznim testiranjem, takšno testiranje pa je priporočljivo za posameznike z diagnozo FAP in njihove družinske člane.
Atenuirana družinska adenomatozna polipoza (AFAP) je blažja različica FAP. Pri prizadetih članih se razvije manj kot 100 polipov debelega črevesa. Kljub temu so pri njih še vedno zelo veliko tveganje za razvoj raka debelega črevesa v mladosti. Prav tako so v nevarnosti, da bodo imeli polipe želodca in dvanajstnika.
Dedni nepolipozni rak debelega črevesa (znan tudi kot Lynchov sindrom ali HNPCC) je dedni sindrom kolorektalnega raka, pri katerem lahko prizadeti družinski člani razvijejo polipe in raka debelega črevesa, običajno v desnem debelem črevesu, v svojih 30-ih do 40-ih letih. Pri bolnikih s HNPCC obstaja tudi tveganje za razvoj raka maternice, želodca, raka jajčnikov in raka sečevodov (cevi, ki povezujejo ledvice z mehurjem) in žolčevodov. Ironično se zdi, da čeprav se rak debelega črevesa pogosteje pojavlja pri bolnikih s HNPCC, je te vrste raka mogoče lažje pozdraviti kot "sporadične" rake debelega črevesa. Ugotovljene so bile specifične genetske nenormalnosti, povezane s HNPCC, bolnike in družinske člane pa je mogoče testirati, da ugotovimo, ali je HNPCC prisoten in ali družinski člani nosijo nenormalnost in verjetno zbolijo za rakom.
MYH polipozni sindrom je nedavno odkrit dedni sindrom kolorektalnega raka. Prizadeti člani običajno razvijejo od 10 do 100 polipov pri približno 40 letih in so izpostavljeni velikemu tveganju za razvoj raka debelega črevesa. Tudi tu je bila ugotovljena genetska nenormalnost.
Pomembno si je zapomniti, da velika večina raka debelega črevesa in danke nima ene same prepoznavne kromosomske nepravilnosti, ki bi jo bilo mogoče iskati pri sorodnikih, da bi identificirali posameznike, ki jim grozi kolorektalni rak.
Simptomi kolorektalnega raka so številni in nespecifični. Vključujejo utrujenost, šibkost, težko dihanje, spremembo črevesnih navad, ozko blato, drisko ali zaprtje, rdečo ali temno kri v blatu, hujšanje, bolečine v trebuhu, krče ali napenjanje. Druga stanja, kot so sindrom razdražljivega črevesja (spastično debelo črevo), ulcerozni kolitis, Crohnova bolezen, divertikuloza in peptična ulkusna bolezen, imajo lahko simptome, ki posnemajo raka črevesja.
Rak debelega črevesa in danke je lahko prisoten več let, preden se pojavijo simptomi. Simptomi se razlikujejo glede na to, kje v debelem črevesu se tumor nahaja. Desno debelo črevo je širše in bolj prožno. Lahko ga celo imenujemo razmeroma prostoren v primerjavi s preostalim delom debelega črevesa. Rak desnega debelega črevesa lahko naraste do velikih velikosti, preden povzroči kakršne koli trebušne simptome. Značilno je, da desnostranski rak povzroči anemijo zaradi pomanjkanja železa zaradi počasne izgube krvi v daljšem časovnem obdobju. Anemija zaradi pomanjkanja železa povzroča utrujenost, šibkost in težko dihanje. Levo debelo črevo je ožje od desnega debelega črevesa. Zato je pri raku levega debelega črevesa večja verjetnost, da povzroči delno ali popolno obstrukcijo črevesja. Raki, ki povzročajo delno obstrukcijo črevesja, lahko povzročijo simptome zaprtja, zoženega blata, driske, bolečine v trebuhu, krče in napenjanje. Svetlo rdeča kri v blatu lahko kaže tudi na rast blizu konca levega debelega črevesa ali danke.
Če sumite na rak debelega črevesa, se običajno opravi kolonoskopija za potrditev diagnoze in lociranje tumorja.
Kolonoskopija je postopek, pri katerem zdravstveni delavec vstavi dolgo, fleksibilno cev za gledanje v danko z namenom pregleda notranjosti celotnega debelega črevesa. Kolonoskopija je na splošno bolj natančna od rentgenskih žarkov z barijevim klistirjem, zlasti pri odkrivanju majhnih polipov. Če najdemo polipe debelega črevesa, jih običajno odstranimo skozi kolonoskop in pošljemo patologu. Patolog pregleda polipe pod mikroskopom, da preveri raka. Kolonoskopija je najboljši postopek za uporabo pri sumu na rak debelega črevesa. Medtem ko je večina polipov, odstranjenih s kolonoskopom, benignih, je veliko predrakavih. Odstranitev predrakavih polipov preprečuje prihodnji razvoj raka debelega črevesa iz teh polipov.
Sigmoidoskopija je postopek, ki se izvaja z uporabo krajšega fleksibilnega obsega za pregled le levega debelega črevesa in danke. Lažje je pripraviti in izvesti kot popolno kolonoskopijo, vendar ima očitne omejitve v smislu, da ni dovolj dolg za oceno tako desnega kot prečnega debelega črevesa. S sigmoidoskopom se lahko izvede odstranitev polipa in biopsija raka.
Če med kolonoskopijo odkrijemo rakaste izrastke, lahko vzamemo majhne vzorce tkiva (biopsije) in jih pregledamo pod mikroskopom, da ugotovimo, ali je polip rakast. Če je rak debelega črevesa potrjen z biopsijo, se opravijo etapne preiskave, da se ugotovi, ali se je rak že razširil na druge organe. Ker se rak debelega črevesa in danke nagiba k širjenju v pljuča in jetra, uprizoritveni testi običajno vključujejo CT pljuč, jeter in trebuha. Positronska emisijska tomografija (PET), novejši test, ki išče povečano presnovno aktivnost, ki je običajna v rakastem tkivu, se prav tako pogosto uporablja za iskanje širjenja raka debelega črevesa na bezgavke ali druge organe.
Včasih lahko zdravstveni delavec pridobi krvni test "tumorskih markerjev", imenovan karcinoembrionalni antigen (CEA), če obstaja sum na raka. CEA je snov, ki jo proizvajajo nekatere rakave celice debelega črevesa in danke ter nekatere druge vrste raka. Včasih ga najdemo v visokih koncentracijah pri bolnikih s kolorektalnim rakom, zlasti ko se bolezen razširi. Lahko služi kot koristen test, ki ga je treba spremljati, če se ugotovi, da je povišan pred odstranitvijo raka. Vendar pa vsi bolniki s kolorektalnim rakom ne bodo imeli povišane CEA, tudi če se je njihov rak razširil. (Nekateri rak debelega črevesa in danke ga ne povzroča.) Poleg tega nekateri bolniki brez rak ima lahko povišan krvni test CEA. Približno 15 % kadilcev bo imelo na primer povišano CEA brez raka debelega črevesa. CEA se torej ne uporablja za diagnosticiranje raka debelega črevesa in danke, temveč za spremljanje učinkov zdravljenja raka debelega črevesa in danke pri nekom z znano anamnezo bolezni, ker spet pri nekaterih bolnikih količina rakavega tkiva korelira z ravnjo CEA.
Ko se diagnosticira rak debelega črevesa in danke, se opravijo dodatni testi za določitev obsega bolezni. Ta proces se imenuje uprizoritev. Stadiranje določa, kako napredoval je kolorektalni rak. Stopnje za kolorektalni rak segajo od stopnje I, najmanj napredovalega raka, do stopnje IV, najbolj napredovalega raka.
Z vsako naslednjo stopnjo raka debelega črevesa se poveča tveganje za ponovitev raka in smrt zaradi širjenja raka (metastaz). Kot smo omenili, imajo zgodnejši raki manjše tveganje za ponovitev in smrt. Do takrat, ko ima posameznik kolorektalni rak stopnje IV, je napoved slaba. Vendar pa tudi pri raku debelega črevesa in danke IV stopnje (odvisno od tega, kje se je rak razširil) obstaja možnost ozdravitve.
Kirurgija je najpogostejše začetno zdravljenje raka debelega črevesa in danke. Med operacijo se odstrani tumor, majhen rob okoliškega zdravega črevesa in sosednje bezgavke. Kirurg nato ponovno poveže zdrave dele črevesja. Pri bolnikih z rakom danke se danka včasih trajno odstrani, če se rak pojavi prenizko v danki. Kirurg nato ustvari odprtino (kolostomo) na trebušni steni, skozi katero se izločajo trdni odpadki iz debelega črevesa. Posebno usposobljene medicinske sestre (enterostomalni terapevti) lahko pomagajo bolnikom, da se prilagodijo kolostomi, večina bolnikov s kolostomi pa se vrne k običajnemu življenjskemu slogu.
Pri zgodnjih črevesnih rakih je priporočeno zdravljenje kirurška odstranitev. Za večino ljudi z zgodnjim stadijem raka debelega črevesa (stopnja I in večina stopnje II) je edino potrebno zdravljenje samo operacija. Kemoterapijo lahko ponudimo nekaterim ljudem z rakom v stadiju II, ki imajo dejavnike, ki kažejo, da je njihov tumor lahko izpostavljen večjemu tveganju za ponovitev. Ko pa se rak debelega črevesa razširi na lokalne bezgavke (III. stopnja), ostaja tveganje za vrnitev raka veliko, tudi če je kirurg odstranil vse vidne znake raka. To je posledica povečane verjetnosti, da so drobne rakave celice morda pobegnile pred operacijo in so premajhne, da bi jih takrat lahko odkrili s krvnimi preiskavami, skeniranjem ali celo neposrednim pregledom. Njihova prisotnost izhaja iz večjega tveganja za kasnejšo ponovitev raka debelega črevesa (relaps). Zdravniki raka (medicinski onkologi) priporočajo dodatno zdravljenje raka debelega črevesa s kemoterapijo v tem okolju, da se zmanjša tveganje za ponovitev raka. Zdravila, ki se uporabljajo za kemoterapijo, vstopijo v krvni obtok in napadejo vse celice raka debelega črevesa, ki so bile pred operacijo izločene v kri ali limfni sistem, skušajo jih ubiti, preden se namestijo v drugih organih. Ta strategija, imenovana adjuvantna kemoterapija, dokazano znižuje tveganje za ponovitev raka in je priporočljiva za vse bolnike z rakom debelega črevesa III stopnje, ki so dovolj zdravi, da jo lahko opravijo, kot tudi za nekatere bolnike z višjim tveganjem za stopnjo II, katerih tumor bi lahko imel je bilo ugotovljeno, da je pred operacijo zamašilo ali perforiralo črevesno steno.
Obstaja več različnih možnosti za adjuvantno kemoterapijo za zdravljenje raka debelega črevesa. Zdravljenje vključuje kombinacijo kemoterapevtskih zdravil, ki se dajejo peroralno ali v žile. Zdravljenje se običajno izvaja skupaj šest mesecev. Pomembno je, da se srečate z onkologom, ki vam lahko razloži možnosti adjuvantne kemoterapije in neželene učinke, na katere morate biti pozorni, da se lahko za pacienta kot posameznika izbere prava izbira.
Kemoterapija se običajno izvaja v ambulanti zdravstvenih delavcev, v bolnišnici kot ambulantno ali doma. Kemoterapija se običajno izvaja v ciklih zdravljenja, ki jim sledijo obdobja okrevanja brez zdravljenja. Neželeni učinki kemoterapije se razlikujejo od osebe do osebe in so odvisni tudi od danih zdravil. Sodobna zdravila za kemoterapijo se običajno dobro prenašajo, stranski učinki pa so za večino ljudi obvladljivi. Na splošno zdravila proti raku uničijo celice, ki hitro rastejo in se delijo. Zato lahko kemoterapija vpliva na normalne rdeče krvne celice, trombocite in bele krvne celice, ki prav tako hitro rastejo. Posledično so pogosti neželeni učinki anemija, izguba energije in nizka odpornost na okužbe. Tudi celice v lasnih koreninah in črevesju se hitro delijo. Zato lahko kemoterapija povzroči izpadanje las, rane v ustih, slabost, bruhanje in drisko, vendar so ti učinki prehodni.
Ko se rak debelega črevesa in danke razširi daleč od primarnega tumorskega mesta, ga opisujejo kot bolezen stopnje IV. Te oddaljene tumorske usedline, izločene iz primarnega tumorja, so potovale skozi krvni ali limfni sistem in tvorile nove tumorje v drugih organih. Takrat rak debelega črevesa in danke ni več lokalna težava, temveč je sistemska težava z rakavimi celicami, ki so vidne na skeniranju in jih ni mogoče zaznati, vendar je verjetno prisoten drugje po telesu. Posledično je v večini primerov najboljše zdravljenje kemoterapija, ki je sistemska terapija. Dokazano je, da kemoterapija pri metastatskem raku debelega črevesa in danke podaljšuje življenje in izboljšuje kakovost življenja. Če se dobro upravlja, so stranski učinki kemoterapije običajno veliko manjši od stranskih učinkov nenadzorovanega raka. Sama kemoterapija ne more ozdraviti metastatskega raka debelega črevesa, lahko pa več kot podvoji pričakovano življenjsko dobo in omogoči dobro kakovost življenja v času zdravljenja.
Možnosti kemoterapije za zdravljenje kolorektalnega raka se razlikujejo glede na druge zdravstvene težave, s katerimi se posameznik sooča. Za zdrave posameznike se običajno priporočajo kombinacije več kemoterapevtskih zdravil, medtem ko so za bolj bolne morda najboljša enostavnejša zdravljenja. Različni režimi z več zdravili združujejo zdravila z dokazano aktivnostjo pri raku debelega črevesa in danke, kot je 5-fluorouracil (5-FU), ki se pogosto daje z zdravilom levkovorin (imenovano tudi folinska kislina) ali podobnim zdravilom, imenovanim levoleucovorin, ki pomaga pri boljšem delovanju.
Kapecitabin (Xeloda) je zdravilo za kemoterapijo, ki se daje v obliki tablet. Ko pride v telo, se spremeni v 5-FU, ko pride na mesto tumorja. Druga zdravila za kemoterapijo za kolorektalni rak so irinotekan (Camptosar), oksaliplatin (Eloxatin) ter trifluridin in tipiracil (Lonsurf), kombinirano zdravilo v obliki tablet. Sheme kemoterapije imajo pogosto kratice za poenostavitev njihove nomenklature (kot so FOLFOX, FOLFIRI in FLOX).
Targeted therapies are newer treatments that target specific aspects of the cancer cell, which may be more important to the tumor than the surrounding tissues, offering potentially effective treatments with fewer side effects than traditional chemotherapy. Bevacizumab (Avastin), cetuximab (Erbitux), panitumumab (Vectibix), ramucirumab (Cyramza), regorafenib (Stivarga), and ziv-aflibercept (Zaltrap) are targeted therapies that have been used in the management of advanced colorectal cancer. These newer chemotherapeutic agents most often are combined with standard chemotherapy to enhance their effectiveness.
If the first treatment is not effective, second- and third-line options are available that can confer a benefit to people living with colorectal cancer.
Radiation therapy is the primary treatment of colorectal cancer has been limited to treating cancer of the rectum. As noted earlier, whereas parts of the colon move freely within the abdominal cavity, the rectum is fixed in place within the pelvis. It is in an intimate relationship with many other structures and the pelvis is a more confined space. For these reasons, a tumor in the rectum often is harder to remove surgically because space is smaller and other structures can be involved with cancer. As a result, for all but the earliest rectal cancers, initial chemotherapy and radiation treatments (a local treatment to a defined area) are recommended to try and shrink cancer, allowing for easier removal and lowering the risk of cancer returning locally. Radiation therapy is typically given under the guidance of a radiation specialist called a radiation oncologist. Initially, individuals undergo a planning session, a complicated visit as the doctors and technicians determine exactly where to give the radiation and which structures to avoid. Chemotherapy usually is administered daily while the radiation is delivered. Side effects of radiation treatment include fatigue, temporary or permanent pelvic hair loss, and skin irritation in the treated areas.
Radiation therapy will occasionally be used as a palliative treatment to reduce pain from the recurrent or metastatic colon or rectal cancer.
Follow-up exams are important for people with colorectal cancer. The cancer can come back near the original site, although this is unusual. If the cancer returns, it typically does so in a distant location such as the lymph nodes, liver, or lungs. Individuals diagnosed with colorectal cancer remain at risk of their cancer returning for up to 10 years after their original diagnosis and treatment, although the risk of recurrence is much higher in the first few years. Medical providers in the United States follow patients with physical examinations and blood tests including the CEA (if it was elevated before surgery) tumor marker every three months for the first two years and then with decreasing frequency thereafter. Patients are also followed with colonoscopies (starting one year after their diagnosis) and with CT scans (typically performed at least once yearly for the first two to five years).
If a recurrence is noted either locally or with metastatic spread, individuals may still be treated with the intention of cure. For example, if a new tumor were to recur in the liver, individuals can be treated with a combination of chemotherapy and surgery (or sophisticated radiation techniques) in hopes of eradicating the cancer completely. Evaluation in hospitals of excellence that specialize in liver surgery can help guide these complicated treatment decisions and increase the chances of cure even in the setting of metastatic disease.
In addition to checking for cancer recurrence, patients who have had bowel cancer may have an increased risk of cancer of the prostate, breast, and ovary. Therefore, follow-up examinations in the clinic should include cancer screening for these diseases, as well.
Colorectal cancers are typically slow-growing cancers that take years to develop. Because they grow most often in a step-wise manner, screening can greatly reduce the likelihood of death associated with the disease. Whether with virtual colonoscopy or newer screening techniques, the future must focus first and foremost on better, more comprehensive screening programs that find polyps and early cancers before they become life-threatening. The public also must be educated on the value of screening programs.
For those living with cancer, intensive research is ongoing to better understand cancer biology and genetics so that specific approaches can be developed to attack specific types of cancers and, more importantly, specific individuals' cancers. Each person living with cancer has a disease with a unique biology and genetic code and the secret to better treatments involves unlocking that code. Cancer is very complex and scientists are just beginning to unravel its secrets. Progress is frustratingly slow for those battling the disease. With each passing year, however, our understanding increases and treatments become more refined. If you or your family member is living with colorectal cancer, speak with your doctor about ways you can participate in research through clinical trials to help increase our knowledge and improve our therapies for this difficult disease.
Survival rates for any cancer are often reported by stage, the extent of spread when the cancer is identified. For colon and rectum cancer, around 39% are diagnosed at the local stage, before the cancer has spread outside the local area. The five-year survival for these patients with localized colon and rectum cancer is around 90%.
When the cancer has spread to the regional lymph nodes near the site of origin, the five-year survival rate is about 71%. When the cancer has metastasized to distant sites in the body (stage IV cancer), the five-year survival rate lowers to about 14%.
The most effective prevention for colorectal cancer is early detection and removal of precancerous colorectal polyps before they turn cancerous. Even in cases where cancer has already developed, early detection still significantly improves the chances of a cure by surgically removing the cancer before the disease spreads to other organs.
Regular physical activity is associated with lower risk of colon cancer. Aspirin use also appears to lower the risk of bowel cancer. The use of combined estrogen and progestin in hormone replacement therapy lowers the risk of colon cancer in postmenopausal women. Hormone replacement therapy has risks which must be weighed against this effect, and should be discussed with a doctor.
Blood tests are now available to test for hereditary colon cancer syndromes. Families with multiple members having colon cancers, multiple colon polyps, cancers at young ages, and other cancers such as cancers of the ureters, uterus, duodenum, and more, may take advantage of resources such as genetic counseling, followed possibly by genetic testing. Genetic testing without prior counseling is discouraged because of the extensive family education that is involved and the complicated nature of interpreting the test results.
The advantages of genetic counseling followed by genetic testing include:(1) identifying family members at high risk of developing colon cancer to begin colonoscopies early; (2) identifying high-risk members so that screening may begin to prevent other cancers such as ultrasound tests for uterine cancer, urine examinations for ureter cancer, and upper endoscopies for stomach and duodenal cancers; and (3) alleviating concern for members who test negative for the hereditary genetic defects.
People can change their eating habits by reducing fat intake and increasing fiber (roughage) in their diet. Major sources of fat are meat, eggs, dairy products, salad dressings, and oils used in cooking. Fiber is the insoluble, nondigestible part of plant material present in fruits, vegetables, and whole-grain breads and cereals. It is postulated that high fiber in the diet leads to the creation of bulky stools which can rid the intestines of potential carcinogens. In addition, fiber leads to the more rapid transit of fecal material through the intestine, thus allowing less time for a potential carcinogen to react with the intestinal lining.
The term "screening" is properly applied only to the use of testing to look for evidence of cancer or pre-cancerous polyps in individuals who are asymptomatic and at only average risk for a type of cancer. Those patients who, for example, have a positive family history of colon cancer, or are symptomatic for a colon abnormality, undergo diagnostic testing rather than screening tests.
There are different types of screening tests for colorectal cancer:fecal (stool) occult blood testing, sigmoidoscopy, colonoscopy, digital colonoscopy, and DNA testing of the stool. The US Preventive Services Task Force (USPSTF) recommends strongly that screening begin at age 50 years for average-risk adults, but there is no specific recommendation for one screening test or strategy over another. The USPSTF advises that patients be offered a choice of screening options, using shared decision-making with the patient and physician to arrive at the best choice of screening programs for each individual.
Tumors of the colon and rectum tend to bleed slowly into the stool. The small amount of blood mixed into the stool usually is not visible to the naked eye. The commonly used stool occult blood tests rely on chemical color conversions to detect microscopic amounts of blood. These tests are both convenient and inexpensive. There are two kinds of fecal occult blood tests. The first is known as a guaiac FOBT. In this test, a small amount of stool is smeared on a special card for occult blood testing when a chemical is added to the card. Usually, three consecutive stool cards are collected. The other type of FOBT is an immunochemical test in which a special solution is added to the stool sample and analyzed in the laboratory using antibodies that can detect blood in a stool sample. The immunochemical test is a quantitative test that is more sensitive and specific for the diagnosis of polyps and cancer. It is preferred over the guaiac test.
A person who tests positive for stool occult blood has a 30%-45% chance of having a colon polyp and a 3%-5% chance of having a colon cancer. Colon cancers found under these circumstances tend to be small and not to have spread and have a better long-term prognosis.
It is important to remember that having stool tested positive for occult blood does not necessarily mean a person has colon cancer. Many other conditions can cause occult blood in the stool. However, patients with a positive stool occult blood test should undergo further evaluations to exclude colon cancer and to explain the source of the bleeding. It is also important to realize that stool that has tested negative for occult blood does not mean that colorectal cancer or polyps do not exist. Even under ideal testing conditions, a significant percentage of colon cancers can be missed by stool occult blood screening. Many patients with colon polyps do not have positive stool occult blood. In patients suspected of having colorectal polyps and in those at higher risk for developing colorectal polyps and cancer, screening flexible sigmoidoscopies or colonoscopies are performed even if the FOBT is negative.
Flexible sigmoidoscopy is an exam of the rectum and the lower colon (60 cm or about 2 feet in from the outside) using a viewing tube (a short version of colonoscopy). Research studies have shown that the use of screening flexible sigmoidoscopy can reduce mortality from colon cancer. This is a result of the detection of polyps or early cancers in people with no symptoms. If a polyp or cancer is found, a complete colonoscopy is recommended. The majority of colon polyps can be completely removed at the time of colonoscopy without surgery; however, polyps in the proximal colon that cannot be reached by the sigmoidoscope will be missed. Flexible sigmoidoscopy is often combined with fecal occult blood testing for colorectal cancer screening.
Colonoscopy uses a long (120 cm-150 cm) flexible tube, which can examine the entire length of the colon. Through this tube, the doctor (typically a gastroenterologist) can both view and take pictures of the entire colon and also can take biopsies of colon masses and remove polyps.
Patients with a high risk of developing colorectal cancer may undergo screening colonoscopies starting at earlier ages than 50. For example, patients with a family history of colon cancer are recommended to start screening colonoscopies at an age 10 years before the earliest colon cancer diagnosed in a first-degree relative or five years earlier than the earliest precancerous colon polyp discovered in a first-degree relative. Patients with hereditary colon cancer syndromes such as FAP, AFAP, HNPCC, and MYH are recommended to begin colonoscopies early. The recommendations differ depending on the genetic defect. For example, in people with FAP, colonoscopies may begin during teenage years to look for the development of colon polyps. Patients with a prior history of polyps or colon cancer may also undergo colonoscopies to exclude recurrence. Patients with a long history (greater than 10 years) of chronic ulcerative colitis have an increased risk of colon cancer and should have regular colonoscopies to look for precancerous changes in the colon lining.
Virtual colonoscopy (computerized tomographic or CT colonography) has been utilized in the clinic as a screening technique for colorectal cancer. Virtual colonoscopy employs a CT scan using low doses of radiation with special software to visualize the inside of the colon and look for polyps or masses. The procedure typically involves a bowel preparation with laxatives and/or enemas (although not always) followed by a CT scan after air is introduced into the colon. Because no sedation is necessary, individuals can return to work or other activities upon completion of the test. Virtual colonoscopies appear to be equally able to detect larger polyps (over 1 centimeter in size) as regular colonoscopies. The virtual colonoscopy cannot be used to biopsy or remove tissue from the colon. A follow-up sigmoidoscopy or colonoscopy must be done to accomplish that.
The Cologuard test is available in the U.S. for in-home sample collection for adults over 50 at average risk for colon cancer. The sample is sent to a laboratory for analysis of DNA changes in DNA from cells shed by the intestinal lining into the stool or hemoglobin in the sample. In a research study, the test was able to find 92% of colon cancers and 69% of precancers of the colon. False-negative and false-positive results are also possible.
 Malo dokazov za trombocitopenijo, povezano s cepivom mRNA COVID-19,
predlaga novo študijo FDA Kljub temu, da je bilo za boj proti pandemiji koronavirusa 2019 (COVID-19) uvedenih veliko cepiv, poročali so o nekaterih resnih škodljivih učinkih, v obliki trombocitopenije
Malo dokazov za trombocitopenijo, povezano s cepivom mRNA COVID-19,
predlaga novo študijo FDA Kljub temu, da je bilo za boj proti pandemiji koronavirusa 2019 (COVID-19) uvedenih veliko cepiv, poročali so o nekaterih resnih škodljivih učinkih, v obliki trombocitopenije
 Infliksimab lahko ovira učinkovitost nekaterih cepiv proti COVID-19
Ker številne države močno prizadenejo ponavljajoči se valovi hude okužbe s koronavirusom 2 (SARS-CoV-2), s povezano visoko stopnjo simptomatske koronavirusne bolezni 2019 (COVID-19), pojav bolj prenos
Infliksimab lahko ovira učinkovitost nekaterih cepiv proti COVID-19
Ker številne države močno prizadenejo ponavljajoči se valovi hude okužbe s koronavirusom 2 (SARS-CoV-2), s povezano visoko stopnjo simptomatske koronavirusne bolezni 2019 (COVID-19), pojav bolj prenos
 Odpiranje ozkega požiralnika
Če ste imeli dolgotrajne težave z zgago, to je morda povzročilo brazgotinjenje v požiralniku. Kriv je pogost refluks želodčne kisline. Zdaj, brazgotinsko tkivo je ustvarilo zožen del požiralnika, ki v
Odpiranje ozkega požiralnika
Če ste imeli dolgotrajne težave z zgago, to je morda povzročilo brazgotinjenje v požiralniku. Kriv je pogost refluks želodčne kisline. Zdaj, brazgotinsko tkivo je ustvarilo zožen del požiralnika, ki v