 Rak debelog crijeva treći je vodeći uzrok raka u SAD-u
Rak debelog crijeva treći je vodeći uzrok raka u SAD-uZnakovi i simptomi raka debelog crijeva obično nisu specifični. Drugim riječima, znakovi i simptomi mogu se pojaviti zbog niza različitih stanja. Kada se rak debelog crijeva otkrije u svojim ranim fazama, možda čak i nije izazvao simptome. Simptomi se također mogu razlikovati ovisno o specifičnom mjestu unutar debelog crijeva gdje se tumor nalazi.
Neki simptomi i znakovi raka debelog crijeva su:

Svaki dan u našim tijelima događa se masivni proces uništenja i popravka. Ljudsko tijelo se sastoji od oko 15 trilijuna stanica, a svaki dan milijarde stanica se troše ili uništavaju. U većini slučajeva, svaki put kada je stanica uništena, tijelo stvara novu stanicu da je zamijeni, pokušavajući napraviti stanicu koja je savršena kopija stanice koja je uništena jer zamjenska stanica mora biti sposobna obavljati istu funkciju kao i stanica. uništena stanica. Tijekom složenog procesa zamjene ćelija dolazi do mnogih pogrešaka. Unatoč izvanredno elegantnim sustavima za sprječavanje pogrešaka, tijelo i dalje čini desetke tisuća pogrešaka dnevno dok zamjenjuje stanice bilo zbog slučajnih pogrešaka ili zbog vanjskih pritisaka na proces zamjene koji potiču pogreške. Većina ovih pogrešaka se ispravlja dodatnim elegantnim sustavima ili greška dovodi do smrti novonastale stanice, te se stvara još jedna normalna nova stanica. Međutim, ponekad se napravi pogreška i ne ispravi se. Mnoge neispravljene pogreške imaju mali učinak na zdravlje, ali ako pogreška dopušta novonastaloj stanici da se dijeli neovisno o provjerama i ravnotežama koje kontroliraju normalan rast stanica, ta se stanica može početi razmnožavati na nekontroliran način. Kada se to dogodi, može se razviti tumor (u suštini masa abnormalnih stanica).
Tumori se dijele u dvije kategorije:postoje benigni (nekancerozni) tumori i maligni (kancerogeni) tumori. Pa u čemu je razlika? Odgovor je da benigni tumor raste samo u tkivu iz kojeg nastaje. Benigni tumori ponekad mogu narasti prilično veliki ili brzo i uzrokovati teške simptome, čak i smrt, iako većina ne. Na primjer, fibroidni tumor u ženskoj maternici je vrsta benignog tumora. Može uzrokovati krvarenje ili bol, ali nikada neće izaći izvan maternice i rasti kao novi tumor negdje drugdje. Fibroidi, kao i svi benigni tumori, nemaju sposobnost izbacivanja stanica u krv i limfni sustav, pa nisu u mogućnosti putovati na druga mjesta u tijelu i rasti. Rak, s druge strane, može odbaciti stanice koje mogu putovati kroz krv ili limfni sustav, dospjeti u tkiva udaljena od primarnog tumora i prerasti u nove tumore u tim udaljenim tkivima. Ovaj proces širenja na udaljena tkiva, koji se naziva metastaza, definišuća je karakteristika kancerogenog ili malignog tumora.
Benigne tumorske stanice često izgledaju relativno normalno kada se pregledaju pod mikroskopom. Maligne ili kancerogene stanice obično izgledaju abnormalnije kada se na sličan način gledaju pod mikroskopom.
Rak je skupina od više od 100 različitih bolesti, slično kao zarazne bolesti. Rakovi se nazivaju prema tkivima iz kojih nastaje prvi tumor. Dakle, rak pluća koji putuje u jetru nije rak jetre, već se opisuje kao rak pluća koji metastazira u jetru, a rak dojke koji se širi na mozak nije opisan kao tumor na mozgu, već kao rak dojke koji metastazira na jetru. mozak. Svaki rak je druga bolest s različitim mogućnostima liječenja i različitim prognozama (vjerojatni ishodi ili očekivano trajanje života). Zapravo, svaki pojedinac s rakom ima jedinstvenu bolest, a relativni uspjeh ili nedostatak liječenja među pacijentima s istom dijagnozom može biti vrlo različit. Kao rezultat toga, važno je liječiti svaku osobu s dijagnozom raka kao pojedinca, bez obzira na vrstu raka.
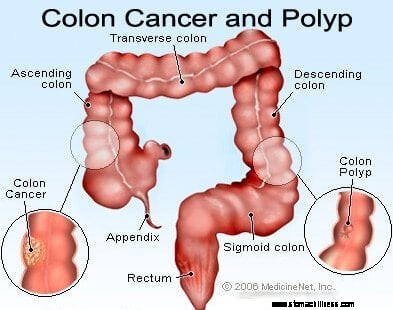 Slika raka debelog crijeva (kolorektalnog).
Slika raka debelog crijeva (kolorektalnog).
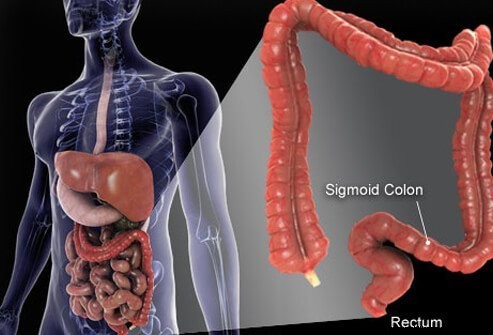
Debelo crijevo i rektum su posljednji dijelovi cijevi koja se proteže od usta do anusa. Hrana ulazi u usta gdje se žvače, a zatim proguta. Zatim putuje kroz jednjak i ulazi u želudac. U želucu se hrana melje u manje čestice, a zatim pažljivo kontrolirano ulazi u tanko crijevo. U tankom crijevu dolazi do konačne probave hrane i apsorpcije hranjivih tvari sadržanih u hrani. Hrana koja se ne probavi i apsorbira ulazi u debelo crijevo (debelo crijevo) i konačno u rektum. Debelo crijevo djeluje prvenstveno kao skladište za otpad; međutim, dodatna voda, soli i neki vitamini se dodatno uklanjaju. Osim toga, dio neprobavljene hrane, na primjer vlakna, probavljaju bakterije debelog crijeva, a neki od produkata probave apsorbiraju se iz debelog crijeva u tijelo. (Procjenjuje se da 10% energije dobivene hranom dolazi od ovih proizvoda bakterijske probave u debelom crijevu.) Preostala neprobavljena hrana, umiruće stanice iz sluznice crijeva i veliki broj bakterija pohranjeni su u debelom crijevu i zatim povremeno prelazi u rektum. Njihov dolazak u rektum pokreće pražnjenje crijeva koje prazni sadržaj debelog crijeva iz tijela u obliku stolice.
Iako je debelo crijevo cijev, ono je strukturno komplicirana cijev, više nalik na radijalnu gumu s čeličnim remenom nego na vrtno crijevo. Cijev se sastoji od četiri sloja. Prvi je unutarnji sloj stanica koji oblažu šupljinu kroz koju putuje neprobavljena i probavljena hrana, nazvana sluznica. Sluznica je pričvršćena za tanki drugi sloj, submucosa, koji je pričvršćen za sloj mišića, muscularis. Cijela je cijev okružena vlaknastim tkivom (nalik ožiljku) zvanim seroza. Najčešći karcinomi debelog crijeva (tip koji se naziva adenokarcinom) nastaju iz sluznice, unutarnjeg sloja stanica. Ove stanice su izložene toksinima iz hrane i bakterija, kao i mehaničkom trošenju, te se relativno brzo prevrću (odumru i zamjenjuju se). Pogreške (obično niz pogrešaka koje uključuju gene unutar zamjenskih stanica) dovode do abnormalnih stanica i nekontrolirane proliferacije abnormalnih stanica koje dovode do raka. Brza promjena omogućuje više pogrešaka u usporedbi s tkivima koja se ne okreću tako brzo (na primjer, tkivo jetre).
Većina debelog crijeva leži unutar trbušne šupljine koja se naziva peritonealna šupljina. Dijelovi debelog crijeva mogu se slobodno kretati unutar peritonealne šupljine dok neprobavljena hrana prolazi kroz nju. Kako se debelo crijevo kreće prema rektumu, ono postaje fiksirano za tkiva iza peritonealne šupljine, područje koje se naziva retroperitoneum. Krajnji dio debelog crijeva, dio koji se nalazi u retroperitoneumu, je rektum. Za razliku od većeg dijela ostatka debelog crijeva, rektum je fiksiran na mjestu pomoću tkiva koja ga okružuju. Zbog svog položaja, liječenje raka rektuma često se razlikuje od liječenja raka ostatka debelog crijeva.
 Slika presjeka debelog crijeva.
Slika presjeka debelog crijeva. 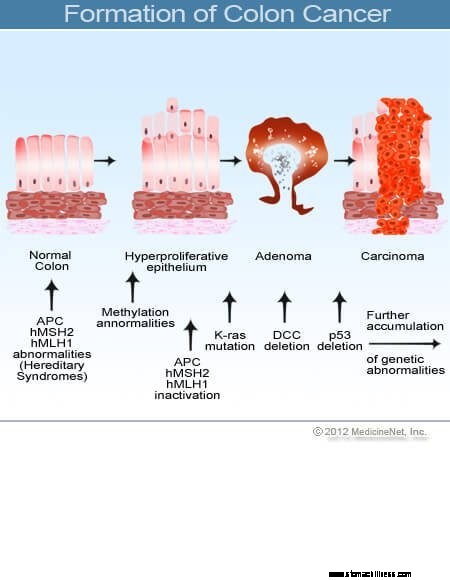 Slika nastanka raka debelog crijeva.
Slika nastanka raka debelog crijeva.
Ljudsko debelo crijevo (debelo crijevo) dugačko je oko 6 stopa.
Karcinomi debelog crijeva i rektuma (kolorektalni karcinom) počinju kada proces normalne zamjene stanica sluznice debelog crijeva krene po zlu. Često se događaju greške u diobi stanica. Iz slabo razumljivih razloga, ponekad se događaju pogreške koje izmiču našim sustavima za uređivanje. Kada se to dogodi, te se stanice počinju dijeliti neovisno o normalnim kontrolama i ravnotežama koje kontroliraju rast. Kako ove abnormalne stanice rastu i dijele se, mogu dovesti do izraslina unutar debelog crijeva zvanih polipi. Polipi se razlikuju po vrsti, ali mnogi su prekancerozni tumori koji rastu sporo tijekom godina i ne šire se. Kako polipi rastu, dodatne genetske mutacije dodatno destabiliziraju stanice. Kada ovi prekancerozni tumori promijene smjer (rastu u stijenku cijevi, a ne u prostor u njenoj sredini) i napadnu druge slojeve debelog crijeva (kao što je submukoza ili mišićni sloj), prekancerozni polip postaje kancerogen. U većini slučajeva ovaj proces je spor, potrebno mu je najmanje osam do 10 godina da se od tih ranih aberantnih stanica razvije do otvorenog raka. Rak debelog crijeva je obično adenokarcinom, pojam koji se odnosi na rak koji je nastao u određenim vrstama tkiva sluznice u tijelu.
Kada se kolorektalni karcinom formira, počinje rasti na dva načina. Prvo, rak može rasti lokalno i proširiti se kroz stijenku crijeva i zahvatiti susjedne strukture, čineći masu (nazvanu primarnim tumorom) većim problemom i težim za uklanjanje. Lokalno proširenje može uzrokovati dodatne simptome kao što su bol ili punoća, perforacija debelog crijeva ili blokade debelog crijeva ili obližnjih struktura. Drugo, kako rak raste, započinje proces metastaziranja, izbacujući tisuće stanica dnevno u krvni i limfni sustav što može uzrokovati nastanak raka na udaljenim mjestima. Kolorektalni karcinom najčešće se prvo širi na lokalne limfne čvorove prije nego što putuje u udaljene organe. Nakon što su zahvaćeni lokalni limfni čvorovi, širenje na jetru, trbušnu šupljinu i pluća sljedeće su najčešće odredište metastatskog širenja.
Rak debelog crijeva je treći najčešći uzrok raka u SAD-u i kod muškaraca i kod žena. Godišnje pogađa više od 135.000 ljudi, što predstavlja 8% svih karcinoma. Oko 4,3% ljudi će u nekom trenutku u životu dobiti dijagnozu raka debelog crijeva ili rektuma.
Klikom na "Pošalji" prihvaćam MedicineNet Uvjete i odredbe i Politiku privatnosti. Također se slažem s primanjem e-poruka od MedicineNeta i razumijem da se mogu odbiti od pretplate na MedicineNet u bilo kojem trenutku.
Zdravstveni djelatnici sigurni su da kolorektalni karcinom nije zarazan (osoba ne može dobiti bolest od oboljelog od raka). Neki ljudi imaju veću vjerojatnost da će razviti kolorektalni rak od drugih. Čimbenici koji povećavaju rizik od raka debelog crijeva uključuju starenje, afroameričku rasu, visok unos masti, obiteljsku anamnezu kolorektalnog karcinoma i polipa, prisutnost polipa u debelom crijevu i upalne bolesti crijeva, prvenstveno kronični ulcerozni kolitis.
Povećana dob glavni je čimbenik rizika za kolorektalni karcinom. Oko 90% kolorektalnog karcinoma dijagnosticira se nakon 50. godine života.
Afroamerikanci imaju veću incidenciju raka debelog crijeva od ljudi drugih rasa.
Brojna istraživanja pokazala su da dijete s visokim udjelom masti predisponira ljude na rak debelog crijeva. U zemljama s visokom stopom raka debelog crijeva, unos masnoća stanovništva je mnogo veći nego u zemljama s niskom stopom raka. Vjeruje se da probava masti koja se događa u tankom crijevu i debelom crijevu dovodi do stvaranja kemikalija koje izazivaju rak (kancerogena). Isto tako, istraživačke studije također otkrivaju da prehrana bogata povrćem i hranom bogatom vlaknima, kao što su kruh od cjelovitog zrna i žitarice, sadrži manje masti koje proizvode te karcinogene i mogu se suprotstaviti učincima kancerogena. Oba bi učinka pomogla u smanjenju rizika od raka.
Istraživanja su pokazala da se većina kolorektalnih karcinoma razvija u kolorektalnim polipima. Stoga, uklanjanje benignih (ali prekanceroznih) kolorektalnih polipa može spriječiti kolorektalni karcinom. Precancerozni kolorektalni polipi najčešće se nazivaju adenomatozni polipi. Razvijaju se kada dođe do oštećenja kromosoma u stanicama unutarnje sluznice debelog crijeva. Oštećenje stvara abnormalne stanice, ali stanice još nisu razvile sposobnost širenja, što je obilježje raka. Umjesto toga, rastuće tkivo ostaje lokalizirano unutar polipa. Kada se kromosomsko oštećenje dodatno povećava unutar polipa, rast stanica postaje nekontroliran, a stanice se počinju širiti, odnosno postaju rak. Dakle, polipi debelog crijeva koji su u početku dobroćudni dobivaju dodatna oštećenja kromosoma kako bi postali kancerogeni.
Kronični ulcerozni kolitis uzrokuje upalu unutarnje sluznice debelog crijeva. Rak crijeva poznata je komplikacija kroničnog ulceroznog kolitisa. Rizik od raka počinje rasti nakon osam do 10 godina kolitisa. Rizik od razvoja raka debelog crijeva u bolesnika s ulceroznim kolitisom također je povezan s mjestom i opsegom njegove ili njezine bolesti.
Pacijenti s većim rizikom od raka su oni s obiteljskom anamnezom raka debelog crijeva, dugotrajnim ulceroznim kolitisom, opsežnim zahvaćanjem debelog crijeva s ulceroznim kolitisom i oni s bolešću jetre povezanom s ulceroznim kolitisom, sklerozirajućim kolangitisom.
Budući da karcinomi povezani s ulceroznim kolitisom imaju povoljniji ishod kada se uhvate u ranijoj fazi, godišnji pregledi debelog crijeva često se preporučuju nakon osam godina poznate opsežne bolesti. Tijekom ovih pretraga uzimaju se uzorci tkiva (biopsije) za traženje prekanceroznih promjena u stanicama koje oblažu debelo crijevo. Kada se pronađu prekancerozne promjene, uklanjanje cijelog debelog crijeva može biti potrebno kako bi se spriječio rak debelog crijeva.
Genetska pozadina osobe važan je čimbenik u riziku od raka debelog crijeva. Imati srodnika u prvom koljenu s kolorektalnim karcinomom, osobito ako je rak dijagnosticiran prije 55. godine života, otprilike udvostručuje rizik od razvoja bolesti.
Iako je obiteljska anamneza raka debelog crijeva važan čimbenik rizika, većina (80%) karcinoma debelog crijeva javlja se sporadično u bolesnika bez obiteljske povijesti raka debelog crijeva. Otprilike 20% karcinoma povezano je s obiteljskom poviješću raka debelog crijeva.
Kromosomi sadrže genetske informacije, a kromosomska oštećenja uzrokuju genetske defekte koji dovode do stvaranja polipa debelog crijeva i kasnije raka debelog crijeva. Kod sporadičnih polipa i karcinoma (polipi i karcinomi koji se razvijaju u nedostatku obiteljske anamneze), oštećenja kromosoma se stječu (razvijaju se u stanici tijekom odraslog života). Oštećeni kromosomi mogu se naći samo u polipima i karcinomima koji se razvijaju iz te stanice. Ali kod nasljednih sindroma raka debelog crijeva, kromosomski defekti se nasljeđuju rođenjem i prisutni su u svakoj stanici u tijelu. Bolesnici koji su naslijedili gene sindroma nasljednog raka debelog crijeva izloženi su riziku od razvoja polipa debelog crijeva, obično u mladoj dobi, te su u vrlo velikom riziku od razvoja raka debelog crijeva u ranoj dobi; također su u opasnosti od razvoja raka u drugim organima.
Obiteljska adenomatozna polipoza (FAP) je jedan nasljedni sindrom kolorektalnog karcinoma gdje će oboljeli članovi obitelji razviti bezbroj (stotine, ponekad i tisuće) polipa debelog crijeva počevši tijekom tinejdžerskih godina. Osim ako se stanje ne otkrije i liječi rano (liječenje uključuje uklanjanje debelog crijeva), osoba zahvaćena FAP-om gotovo će sigurno razviti rak debelog crijeva od ovih polipa. Rak se gotovo sigurno razvija do trenutka kada je osoba u 40-ima. Ovi pacijenti također su izloženi riziku od razvoja drugih karcinoma kao što su karcinomi štitnjače, želuca i ampule (dio žučnog kanala gdje se iz jetre slijeva u tanko crijevo), kao i benigni tumori zvani dezmoidni tumori. FAP nastaje mutacijom u specifičnom genu zvanom APC gen. Specifična mutacija može se identificirati kod većine ljudi odgovarajućim testiranjem, a takvo testiranje se preporučuje osobama s dijagnozom FAP-a, kao i članovima njihovih obitelji.
Atenuirana obiteljska adenomatozna polipoza (AFAP) je blaža verzija FAP-a. Zahvaćeni članovi razvijaju manje od 100 polipa debelog crijeva. Ipak, još uvijek su pod vrlo visokim rizikom od razvoja raka debelog crijeva u mladoj dobi. Također su u opasnosti od polipa želuca i dvanaesnika.
Nasljedni nepolipozni rak debelog crijeva (također poznat kao Lynchov sindrom ili HNPCC) je nasljedni sindrom kolorektalnog karcinoma kod kojeg zahvaćeni članovi obitelji mogu razviti polipe i karcinome debelog crijeva, obično u desnom debelom crijevu, u svojim 30-im do 40-ima. Bolesnice s HNPCC također su izložene riziku od razvoja raka maternice, raka želuca, raka jajnika i raka uretera (cijevi koje povezuju bubrege s mokraćnim mjehurom) i žučnih kanala. Ironično, čini se da, iako se rak debelog crijeva javlja češće u pacijenata s HNPCC, ti se karcinomi mogu lakše izliječiti od "sporadičnih" karcinoma debelog crijeva. Specifične genetske abnormalnosti povezane s HNPCC su identificirane, a pacijenti i članovi obitelji mogu se testirati kako bi se utvrdilo je li HNPCC prisutan i jesu li članovi obitelji nositelji abnormalnosti i vjerojatno će razviti rak.
MYH polipozni sindrom je nedavno otkriveni nasljedni sindrom kolorektalnog karcinoma. Pogođeni članovi obično razviju 10 do 100 polipa u dobi od oko 40 godina i pod visokim su rizikom od razvoja raka debelog crijeva. I ovdje je identificirana genetska abnormalnost.
Važno je zapamtiti da velika većina kolorektalnih karcinoma nema niti jednu, prepoznatljivu kromosomsku abnormalnost koju bi se moglo tražiti kod rođaka kako bi se identificirale osobe s rizikom od raka debelog crijeva.
Simptomi kolorektalnog karcinoma su brojni i nespecifični. Oni uključuju umor, slabost, otežano disanje, promjenu crijevnih navika, usku stolicu, proljev ili zatvor, crvenu ili tamnu krv u stolici, gubitak težine, bolove u trbuhu, grčeve ili nadutost. Druga stanja kao što su sindrom iritabilnog crijeva (spastično kolon), ulcerozni kolitis, Crohnova bolest, divertikuloza i peptički ulkus mogu imati simptome koji oponašaju rak crijeva.
Rak debelog crijeva može biti prisutan nekoliko godina prije nego što se razviju simptomi. Simptomi se razlikuju ovisno o tome gdje se u debelom crijevu tumor nalazi. Desno debelo crijevo je šire i fleksibilnije. Može se čak nazvati relativno prostranim u usporedbi s ostatkom debelog crijeva. Karcinomi desnog debelog crijeva mogu narasti do velikih veličina prije nego što prouzrokuju bilo kakve abdominalne simptome. Tipično, desnostrani karcinomi uzrokuju anemiju zbog nedostatka željeza zbog sporog gubitka krvi tijekom dugog vremenskog razdoblja. Anemija zbog nedostatka željeza uzrokuje umor, slabost i otežano disanje. Lijevo debelo crijevo je uže od desnog debelog crijeva. Stoga je veća vjerojatnost da će karcinomi lijevog debelog crijeva uzrokovati djelomičnu ili potpunu opstrukciju crijeva. Karcinomi koji uzrokuju djelomičnu opstrukciju crijeva mogu uzrokovati simptome zatvora, sužene stolice, proljeva, bolova u trbuhu, grčeva i nadutosti. Svijetlocrvena krv u stolici također može ukazivati na izraslinu blizu kraja lijevog debelog crijeva ili rektuma.
Kada se sumnja na rak debelog crijeva, obično se provodi kolonoskopija kako bi se potvrdila dijagnoza i locirao tumor.
Kolonoskopija je postupak u kojem zdravstveni djelatnik ubacuje dugu, fleksibilnu cijev za gledanje u rektum u svrhu pregleda unutrašnjosti cijelog debelog crijeva. Kolonoskopija se općenito smatra točnijom od rendgenskih zraka s barijevim klistirom, osobito u otkrivanju malih polipa. Ako se pronađu polipi debelog crijeva, obično se uklanjaju kolonoskopom i šalju patologu. Patolog pregledava polipe pod mikroskopom kako bi provjerio ima li raka. Kolonoskopija je najbolja procedura za korištenje kada se sumnja na rak debelog crijeva. Dok je većina polipa uklonjenih kolonoskopom benigna, mnogi su prekancerozni. Uklanjanje prekanceroznih polipa sprječava budući razvoj raka debelog crijeva iz ovih polipa.
Sigmoidoskopija je postupak koji se izvodi korištenjem kraćeg fleksibilnog opsega za pregled samo lijevog debelog crijeva i rektuma. Lakše se priprema i izvodi od potpune kolonoskopije, ali ima očita ograničenja u smislu da nije dovoljno duga za procjenu i desnog i poprečnog debelog crijeva. Uklanjanje polipa i biopsija raka mogu se izvesti putem sigmoidoskopa.
Ako se tijekom kolonoskopije pronađu kancerozne izrasline, mogu se uzeti mali uzorci tkiva (biopsije) i ispitati ih pod mikroskopom kako bi se utvrdilo je li polip kancerogen. Ako se biopsijom potvrdi karcinom debelog crijeva, provode se stadijske pretrage kako bi se utvrdilo je li se rak već proširio na druge organe. Budući da se kolorektalni karcinom ima tendenciju širenja na pluća i jetru, stadijski testovi obično uključuju CT pluća, jetre i abdomena. Pozitronska emisijska tomografija (PET), noviji test koji traži povećanu metaboličku aktivnost koja je uobičajena u kancerogenom tkivu, također se često koristi za traženje širenja raka debelog crijeva na limfne čvorove ili druge organe.
Ponekad zdravstveni djelatnik može dobiti krvni test "tumorskog biljega" koji se zove karcinoembrionalni antigen (CEA) ako postoji sumnja na rak. CEA je tvar koju proizvode neke stanice raka debelog crijeva i rektuma, kao i neke druge vrste raka. Ponekad se nalazi u visokim razinama u bolesnika s kolorektalnim karcinomom, osobito kada se bolest proširila. Može poslužiti kao koristan test za praćenje ako se utvrdi da je povišen prije uklanjanja raka. Međutim, neće svi pacijenti s kolorektalnim karcinomom imati povišen CEA čak i ako se njihov rak proširio. (Neki kolorektalni karcinomi ga ne proizvode.) Osim toga, neki pacijenti bez karcinom može imati povišen CEA krvni test. Oko 15% pušača, na primjer, imat će povišen CEA bez raka debelog crijeva. Dakle, CEA se ne koristi za dijagnosticiranje kolorektalnog karcinoma, već radi praćenja učinaka liječenja kolorektalnog raka kod nekoga s poznatom poviješću bolesti jer, opet, u nekih pacijenata količina kancerogenog tkiva korelira s razinom CEA.
Kada se dijagnosticira kolorektalni karcinom, provode se dodatne pretrage kako bi se utvrdio opseg bolesti. Taj se proces naziva inscenacija. Stadiranje određuje koliko je rak debelog crijeva uznapredovao. Stadijum za kolorektalni karcinom kreće se od stadija I, najmanje uznapredovalog karcinoma, do stadija IV, najnaprednijeg karcinoma.
Sa svakim sljedećim stadijem raka debelog crijeva raste rizik za ponovni rak i smrt zbog širenja raka (metastaza). Kao što je napomenuto, raniji karcinomi imaju manji rizik od recidiva i smrti. Do trenutka kada pojedinac ima kolorektalni rak u stadiju IV, prognoza je loša. Međutim, čak i u stadiju IV kolorektalnog karcinoma (ovisno o tome gdje se rak proširio) postoji mogućnost izlječenja.
Kirurgija je najčešći početni medicinski tretman kolorektalnog karcinoma. Tijekom operacije uklanjaju se tumor, mali rub okolnog zdravog crijeva i susjedni limfni čvorovi. Kirurg zatim ponovno povezuje zdrave dijelove crijeva. U bolesnika s rakom rektuma, rektum se ponekad trajno uklanja ako se rak pojavi prenisko u rektumu. Kirurg tada stvara otvor (kolostomiju) na trbušnoj stijenci kroz koji se izlučuje čvrsti otpad iz debelog crijeva. Posebno educirane medicinske sestre (enterostomalni terapeuti) mogu pomoći pacijentima da se prilagode kolostomama, a većina pacijenata s kolostomom se vrati normalnom načinu života.
Za rane karcinome crijeva, preporučeno liječenje je kirurško uklanjanje. Za većinu ljudi s ranim stadijem raka debelog crijeva (stadij I i većina stadija II), samo kirurški zahvat je jedino potrebno liječenje. Kemoterapija se može ponuditi nekim osobama sa stadijem raka II koji imaju čimbenike koji sugeriraju da njihov tumor može biti pod većim rizikom od ponovnog nastanka. Međutim, nakon što se rak debelog crijeva proširi na lokalne limfne čvorove (stadij III), rizik od ponovnog pojavljivanja raka ostaje visok čak i ako kirurg ukloni sve vidljive dokaze raka. To je zbog povećane vjerojatnosti da su sitne stanice raka pobjegle prije operacije i da su premale da bi se u tom trenutku otkrile krvnim pretragama, skeniranjem ili čak izravnim pregledom. Njihova prisutnost zaključuje se iz većeg rizika od recidiva raka debelog crijeva u kasnijem terminu (relaps). Liječnici raka (medicinski onkolozi) preporučuju dodatne tretmane raka debelog crijeva s kemoterapijom u ovom okruženju kako bi se smanjio rizik od povratka raka. Lijekovi koji se koriste za kemoterapiju ulaze u krvotok i napadaju sve stanice raka debelog crijeva koje su bile proslijeđene u krv ili limfni sustav prije operacije, pokušavajući ih ubiti prije nego što postave dućan u drugim organima. Ova strategija, nazvana adjuvantna kemoterapija, dokazano smanjuje rizik od ponovnog pojavljivanja raka i preporučuje se svim pacijentima s III stadijem raka debelog crijeva koji su dovoljno zdravi da se podvrgnu tome, kao i nekim pacijentima s višim rizikom od II stupnja čiji tumor može imati utvrđeno je da je prije operacije začepio ili perforirao crijevnu stijenku.
Postoji nekoliko različitih opcija za pomoćnu kemoterapiju za liječenje raka debelog crijeva. Liječenje uključuje kombinaciju kemoterapijskih lijekova koji se daju oralno ili u vene. Tretmani se obično daju ukupno šest mjeseci. Važno je sastati se s onkologom koji može objasniti opcije adjuvantne kemoterapije, kao i nuspojave na koje treba pripaziti kako bi se napravio pravi izbor za pacijenta kao pojedinca.
Kemoterapija se obično provodi u klinici zdravstvenih radnika, u bolnici kao ambulantno ili kod kuće. Kemoterapija se obično daje u ciklusima liječenja nakon kojih slijede razdoblja oporavka bez liječenja. Nuspojave kemoterapije razlikuju se od osobe do osobe i također ovise o danim sredstvima. Moderna kemoterapijska sredstva obično se dobro podnose, a nuspojave za većinu ljudi su podnošljive. Općenito, lijekovi protiv raka uništavaju stanice koje brzo rastu i dijele se. Stoga kemoterapija može utjecati na normalne crvene krvne stanice, trombociti i bijele krvne stanice koje također brzo rastu. Kao rezultat toga, uobičajene nuspojave uključuju anemiju, gubitak energije i nisku otpornost na infekcije. Stanice u korijenu kose i crijevima također se brzo dijele. Stoga kemoterapija može uzrokovati gubitak kose, rane u ustima, mučninu, povraćanje i proljev, ali ti učinci su prolazni.
Kada se kolorektalni karcinom proširi daleko od primarnog mjesta tumora, opisuje se kao bolest stadija IV. Te udaljene naslage tumora, koje se izlučuju iz primarnog tumora, putovale su kroz krv ili limfni sustav, stvarajući nove tumore u drugim organima. U tom trenutku, kolorektalni karcinom više nije lokalni problem, već je umjesto toga sistemski problem sa stanicama raka koje su vidljive na skeniranju i koje se ne mogu otkriti, ali vjerojatno su prisutne i drugdje u cijelom tijelu. Kao rezultat toga, u većini slučajeva, najbolji tretman je kemoterapija, što je sustavna terapija. Dokazano je da kemoterapija kod metastatskog kolorektalnog karcinoma produljuje život i poboljšava kvalitetu života. Ako se dobro upravlja, nuspojave kemoterapije su obično daleko manje od nuspojava nekontroliranog raka. Kemoterapija sama po sebi ne može izliječiti metastatski rak debelog crijeva, ali može više nego udvostručiti očekivani životni vijek i omogućiti dobru kvalitetu života tijekom liječenja.
Mogućnosti kemoterapije za liječenje raka debelog crijeva razlikuju se ovisno o drugim zdravstvenim problemima s kojima se pojedinac suočava. Za osobe u formi obično se preporučuju kombinacije nekoliko kemoterapeutskih lijekova, dok za bolesnije osobe mogu biti najbolji jednostavniji tretmani. Različiti režimi s više lijekova kombiniraju lijekove s dokazanim djelovanjem u kolorektalnom karcinomu, kao što je 5-fluorouracil (5-FU), koji se često daje s lijekom leucovorin (koji se također naziva folinska kiselina) ili sličnim lijekom koji se zove levoleucovorin, koji mu pomaže u boljem radu.
Kapecitabin (Xeloda) je lijek za kemoterapiju koji se daje u obliku tableta. Jednom u tijelu, mijenja se u 5-FU kada dođe do mjesta tumora. Ostali lijekovi za kemoterapiju za kolorektalni karcinom su irinotekan (Camptosar), oksaliplatin (Eloxatin) i trifluridin i tipiracil (Lonsurf), kombinirani lijek u obliku tableta. Chemotherapy regimens often have acronyms to simplify their nomenclature (such as FOLFOX, FOLFIRI, and FLOX).
Targeted therapies are newer treatments that target specific aspects of the cancer cell, which may be more important to the tumor than the surrounding tissues, offering potentially effective treatments with fewer side effects than traditional chemotherapy. Bevacizumab (Avastin), cetuximab (Erbitux), panitumumab (Vectibix), ramucirumab (Cyramza), regorafenib (Stivarga), and ziv-aflibercept (Zaltrap) are targeted therapies that have been used in the management of advanced colorectal cancer. These newer chemotherapeutic agents most often are combined with standard chemotherapy to enhance their effectiveness.
If the first treatment is not effective, second- and third-line options are available that can confer a benefit to people living with colorectal cancer.
Radiation therapy is the primary treatment of colorectal cancer has been limited to treating cancer of the rectum. As noted earlier, whereas parts of the colon move freely within the abdominal cavity, the rectum is fixed in place within the pelvis. It is in an intimate relationship with many other structures and the pelvis is a more confined space. For these reasons, a tumor in the rectum often is harder to remove surgically because space is smaller and other structures can be involved with cancer. As a result, for all but the earliest rectal cancers, initial chemotherapy and radiation treatments (a local treatment to a defined area) are recommended to try and shrink cancer, allowing for easier removal and lowering the risk of cancer returning locally. Radiation therapy is typically given under the guidance of a radiation specialist called a radiation oncologist. Initially, individuals undergo a planning session, a complicated visit as the doctors and technicians determine exactly where to give the radiation and which structures to avoid. Chemotherapy usually is administered daily while the radiation is delivered. Side effects of radiation treatment include fatigue, temporary or permanent pelvic hair loss, and skin irritation in the treated areas.
Radiation therapy will occasionally be used as a palliative treatment to reduce pain from the recurrent or metastatic colon or rectal cancer.
Follow-up exams are important for people with colorectal cancer. The cancer can come back near the original site, although this is unusual. If the cancer returns, it typically does so in a distant location such as the lymph nodes, liver, or lungs. Individuals diagnosed with colorectal cancer remain at risk of their cancer returning for up to 10 years after their original diagnosis and treatment, although the risk of recurrence is much higher in the first few years. Medical providers in the United States follow patients with physical examinations and blood tests including the CEA (if it was elevated before surgery) tumor marker every three months for the first two years and then with decreasing frequency thereafter. Patients are also followed with colonoscopies (starting one year after their diagnosis) and with CT scans (typically performed at least once yearly for the first two to five years).
If a recurrence is noted either locally or with metastatic spread, individuals may still be treated with the intention of cure. For example, if a new tumor were to recur in the liver, individuals can be treated with a combination of chemotherapy and surgery (or sophisticated radiation techniques) in hopes of eradicating the cancer completely. Evaluation in hospitals of excellence that specialize in liver surgery can help guide these complicated treatment decisions and increase the chances of cure even in the setting of metastatic disease.
In addition to checking for cancer recurrence, patients who have had bowel cancer may have an increased risk of cancer of the prostate, breast, and ovary. Therefore, follow-up examinations in the clinic should include cancer screening for these diseases, as well.
Colorectal cancers are typically slow-growing cancers that take years to develop. Because they grow most often in a step-wise manner, screening can greatly reduce the likelihood of death associated with the disease. Whether with virtual colonoscopy or newer screening techniques, the future must focus first and foremost on better, more comprehensive screening programs that find polyps and early cancers before they become life-threatening. The public also must be educated on the value of screening programs.
For those living with cancer, intensive research is ongoing to better understand cancer biology and genetics so that specific approaches can be developed to attack specific types of cancers and, more importantly, specific individuals' cancers. Each person living with cancer has a disease with a unique biology and genetic code and the secret to better treatments involves unlocking that code. Cancer is very complex and scientists are just beginning to unravel its secrets. Progress is frustratingly slow for those battling the disease. With each passing year, however, our understanding increases and treatments become more refined. If you or your family member is living with colorectal cancer, speak with your doctor about ways you can participate in research through clinical trials to help increase our knowledge and improve our therapies for this difficult disease.
Survival rates for any cancer are often reported by stage, the extent of spread when the cancer is identified. For colon and rectum cancer, around 39% are diagnosed at the local stage, before the cancer has spread outside the local area. The five-year survival for these patients with localized colon and rectum cancer is around 90%.
When the cancer has spread to the regional lymph nodes near the site of origin, the five-year survival rate is about 71%. When the cancer has metastasized to distant sites in the body (stage IV cancer), the five-year survival rate lowers to about 14%.
The most effective prevention for colorectal cancer is early detection and removal of precancerous colorectal polyps before they turn cancerous. Even in cases where cancer has already developed, early detection still significantly improves the chances of a cure by surgically removing the cancer before the disease spreads to other organs.
Regular physical activity is associated with lower risk of colon cancer. Aspirin use also appears to lower the risk of bowel cancer. The use of combined estrogen and progestin in hormone replacement therapy lowers the risk of colon cancer in postmenopausal women. Hormone replacement therapy has risks which must be weighed against this effect, and should be discussed with a doctor.
Blood tests are now available to test for hereditary colon cancer syndromes. Families with multiple members having colon cancers, multiple colon polyps, cancers at young ages, and other cancers such as cancers of the ureters, uterus, duodenum, and more, may take advantage of resources such as genetic counseling, followed possibly by genetic testing. Genetic testing without prior counseling is discouraged because of the extensive family education that is involved and the complicated nature of interpreting the test results.
The advantages of genetic counseling followed by genetic testing include:(1) identifying family members at high risk of developing colon cancer to begin colonoscopies early; (2) identifying high-risk members so that screening may begin to prevent other cancers such as ultrasound tests for uterine cancer, urine examinations for ureter cancer, and upper endoscopies for stomach and duodenal cancers; and (3) alleviating concern for members who test negative for the hereditary genetic defects.
People can change their eating habits by reducing fat intake and increasing fiber (roughage) in their diet. Major sources of fat are meat, eggs, dairy products, salad dressings, and oils used in cooking. Fiber is the insoluble, nondigestible part of plant material present in fruits, vegetables, and whole-grain breads and cereals. It is postulated that high fiber in the diet leads to the creation of bulky stools which can rid the intestines of potential carcinogens. In addition, fiber leads to the more rapid transit of fecal material through the intestine, thus allowing less time for a potential carcinogen to react with the intestinal lining.
The term "screening" is properly applied only to the use of testing to look for evidence of cancer or pre-cancerous polyps in individuals who are asymptomatic and at only average risk for a type of cancer. Those patients who, for example, have a positive family history of colon cancer, or are symptomatic for a colon abnormality, undergo diagnostic testing rather than screening tests.
There are different types of screening tests for colorectal cancer:fecal (stool) occult blood testing, sigmoidoscopy, colonoscopy, digital colonoscopy, and DNA testing of the stool. The US Preventive Services Task Force (USPSTF) recommends strongly that screening begin at age 50 years for average-risk adults, but there is no specific recommendation for one screening test or strategy over another. The USPSTF advises that patients be offered a choice of screening options, using shared decision-making with the patient and physician to arrive at the best choice of screening programs for each individual.
Tumors of the colon and rectum tend to bleed slowly into the stool. The small amount of blood mixed into the stool usually is not visible to the naked eye. The commonly used stool occult blood tests rely on chemical color conversions to detect microscopic amounts of blood. These tests are both convenient and inexpensive. There are two kinds of fecal occult blood tests. The first is known as a guaiac FOBT. In this test, a small amount of stool is smeared on a special card for occult blood testing when a chemical is added to the card. Usually, three consecutive stool cards are collected. The other type of FOBT is an immunochemical test in which a special solution is added to the stool sample and analyzed in the laboratory using antibodies that can detect blood in a stool sample. The immunochemical test is a quantitative test that is more sensitive and specific for the diagnosis of polyps and cancer. It is preferred over the guaiac test.
A person who tests positive for stool occult blood has a 30%-45% chance of having a colon polyp and a 3%-5% chance of having a colon cancer. Colon cancers found under these circumstances tend to be small and not to have spread and have a better long-term prognosis.
It is important to remember that having stool tested positive for occult blood does not necessarily mean a person has colon cancer. Many other conditions can cause occult blood in the stool. However, patients with a positive stool occult blood test should undergo further evaluations to exclude colon cancer and to explain the source of the bleeding. It is also important to realize that stool that has tested negative for occult blood does not mean that colorectal cancer or polyps do not exist. Even under ideal testing conditions, a significant percentage of colon cancers can be missed by stool occult blood screening. Many patients with colon polyps do not have positive stool occult blood. In patients suspected of having colorectal polyps and in those at higher risk for developing colorectal polyps and cancer, screening flexible sigmoidoscopies or colonoscopies are performed even if the FOBT is negative.
Flexible sigmoidoscopy is an exam of the rectum and the lower colon (60 cm or about 2 feet in from the outside) using a viewing tube (a short version of colonoscopy). Research studies have shown that the use of screening flexible sigmoidoscopy can reduce mortality from colon cancer. This is a result of the detection of polyps or early cancers in people with no symptoms. If a polyp or cancer is found, a complete colonoscopy is recommended. The majority of colon polyps can be completely removed at the time of colonoscopy without surgery; however, polyps in the proximal colon that cannot be reached by the sigmoidoscope will be missed. Flexible sigmoidoscopy is often combined with fecal occult blood testing for colorectal cancer screening.
Colonoscopy uses a long (120 cm-150 cm) flexible tube, which can examine the entire length of the colon. Through this tube, the doctor (typically a gastroenterologist) can both view and take pictures of the entire colon and also can take biopsies of colon masses and remove polyps.
Patients with a high risk of developing colorectal cancer may undergo screening colonoscopies starting at earlier ages than 50. For example, patients with a family history of colon cancer are recommended to start screening colonoscopies at an age 10 years before the earliest colon cancer diagnosed in a first-degree relative or five years earlier than the earliest precancerous colon polyp discovered in a first-degree relative. Patients with hereditary colon cancer syndromes such as FAP, AFAP, HNPCC, and MYH are recommended to begin colonoscopies early. The recommendations differ depending on the genetic defect. For example, in people with FAP, colonoscopies may begin during teenage years to look for the development of colon polyps. Patients with a prior history of polyps or colon cancer may also undergo colonoscopies to exclude recurrence. Patients with a long history (greater than 10 years) of chronic ulcerative colitis have an increased risk of colon cancer and should have regular colonoscopies to look for precancerous changes in the colon lining.
Virtual colonoscopy (computerized tomographic or CT colonography) has been utilized in the clinic as a screening technique for colorectal cancer. Virtual colonoscopy employs a CT scan using low doses of radiation with special software to visualize the inside of the colon and look for polyps or masses. The procedure typically involves a bowel preparation with laxatives and/or enemas (although not always) followed by a CT scan after air is introduced into the colon. Because no sedation is necessary, individuals can return to work or other activities upon completion of the test. Virtual colonoscopies appear to be equally able to detect larger polyps (over 1 centimeter in size) as regular colonoscopies. The virtual colonoscopy cannot be used to biopsy or remove tissue from the colon. A follow-up sigmoidoscopy or colonoscopy must be done to accomplish that.
The Cologuard test is available in the U.S. for in-home sample collection for adults over 50 at average risk for colon cancer. The sample is sent to a laboratory for analysis of DNA changes in DNA from cells shed by the intestinal lining into the stool or hemoglobin in the sample. In a research study, the test was able to find 92% of colon cancers and 69% of precancers of the colon. False-negative and false-positive results are also possible.
 Što se brzo rješava žgaravice?
Što je žgaravica? Žgaravica je neugodan osjećaj peckanja u prsima i grlu. Brzo se riješite žgaravice uz pomoć lijekova, kućne njege i alternativnih terapija. Žgaravica je neugodan osjećaj peckanja
Što se brzo rješava žgaravice?
Što je žgaravica? Žgaravica je neugodan osjećaj peckanja u prsima i grlu. Brzo se riješite žgaravice uz pomoć lijekova, kućne njege i alternativnih terapija. Žgaravica je neugodan osjećaj peckanja
 Strategija pripreme pedijatrijske zdravstvene zaštite za drugi val pandemije COVID-19
Iako je pandemija COVID-19 do sada imala relativno slab utjecaj na pedijatrijsku populaciju, strahuje se da će drugi val, koja je već u tijeku u mnogim dijelovima svijeta, može uzeti danak na mlade i
Strategija pripreme pedijatrijske zdravstvene zaštite za drugi val pandemije COVID-19
Iako je pandemija COVID-19 do sada imala relativno slab utjecaj na pedijatrijsku populaciju, strahuje se da će drugi val, koja je već u tijeku u mnogim dijelovima svijeta, može uzeti danak na mlade i
 Anatomija Crohnove bolesti
Što je Crohnova bolest, na koje dijelove probavnog sustava utječe? Slika Crohnove bolesti Crohnova bolest je kronična upala probavnog trakta. Crohnova bolest je jedna od mnogih vrsta upalnih bolesti
Anatomija Crohnove bolesti
Što je Crohnova bolest, na koje dijelove probavnog sustava utječe? Slika Crohnove bolesti Crohnova bolest je kronična upala probavnog trakta. Crohnova bolest je jedna od mnogih vrsta upalnih bolesti