 Tykktarmskreft er den tredje ledende årsaken til kreft i USA
Tykktarmskreft er den tredje ledende årsaken til kreft i USATegn og symptomer på tykktarmskreft har en tendens til å ikke være spesifikke. Med andre ord kan tegnene og symptomene oppstå på grunn av en rekke forskjellige tilstander. Når tykktarmskreft oppdages i sine tidlige stadier, kan det hende at det ikke en gang har forårsaket symptomer. Symptomer kan også variere i henhold til det spesifikke stedet i tykktarmen der svulsten er lokalisert.
Noen symptomer og tegn på tykktarmskreft er:

Hver dag i kroppen vår skjer det en massiv prosess med ødeleggelse og reparasjon. Menneskekroppen består av omtrent 15 billioner celler, og hver dag milliarder av cellene slites ut eller blir ødelagt. I de fleste tilfeller, hver gang en celle blir ødelagt, lager kroppen en ny celle for å erstatte den, og prøver å lage en celle som er en perfekt kopi av cellen som ble ødelagt fordi erstatningscellen må være i stand til å utføre samme funksjon som ødelagt celle. Under den komplekse prosessen med å erstatte celler, oppstår mange feil. Til tross for bemerkelsesverdig elegante systemer på plass for å forhindre feil, gjør kroppen fortsatt titusenvis av feil daglig mens den erstatter celler enten på grunn av tilfeldige feil eller fordi det er ytre press på utskiftingsprosessen som fremmer feil. De fleste av disse feilene blir korrigert av ekstra elegante systemer, eller feilen fører til døden til den nylagde cellen, og en annen normal ny celle produseres. Noen ganger blir det imidlertid gjort en feil som ikke blir rettet. Mange av de ukorrigerte feilene har liten effekt på helsen, men hvis feilen lar den nylagde cellen dele seg uavhengig av kontrollene og balansene som kontrollerer normal cellevekst, kan den cellen begynne å formere seg på en ukontrollert måte. Når dette skjer, kan en svulst (i hovedsak en masse unormale celler) utvikles.
Svulster faller inn i to kategorier:det er godartede (ikke-kreft) svulster og ondartede (kreft) svulster. Så hva er forskjellen? Svaret er at en godartet svulst bare vokser i vevet den oppstår fra. Godartede svulster kan noen ganger vokse ganske store eller raskt og forårsake alvorlige symptomer, til og med død, selv om de fleste ikke gjør det. For eksempel er en fibroid svulst i en kvinnes livmor en type godartet svulst. Det kan forårsake blødning eller smerte, men det vil aldri reise utenfor livmoren og vokse som en ny svulst andre steder. Fibromer, som alle godartede svulster, mangler kapasitet til å kaste celler inn i blodet og lymfesystemet, så de er ikke i stand til å reise til andre steder i kroppen og vokse. En kreft kan på den annen side kaste ut celler som kan reise gjennom blodet eller lymfesystemet, lande i vev fjernt fra primærsvulsten og vokse til nye svulster i disse fjerne vevene. Denne prosessen med å spre seg til fjerntliggende vev, kalt metastaser, er den definerende egenskapen til en kreft eller ondartet svulst.
Godartede tumorceller ser ofte relativt normale ut når de undersøkes under mikroskop. Ondartede celler eller kreftceller ser vanligvis mer unormale ut når de ses på samme måte under mikroskopet.
Kreft er en gruppe på mer enn 100 forskjellige sykdommer, omtrent som infeksjonssykdommer. Kreft er navngitt av vevet som den første svulsten oppstår fra. Derfor er en lungekreft som går til leveren ikke en leverkreft, men beskrives som lungekreft som metastaserer leveren, og en brystkreft som sprer seg til hjernen beskrives ikke som en hjernesvulst, men snarere som brystkreft som er metastasert til hjerne. Hver kreftform er en annen sykdom med forskjellige behandlingsalternativer og varierende prognoser (sannsynlige utfall eller forventet levealder). Faktisk har hvert individ med kreft en unik sykdom, og den relative suksessen eller mangelen på behandling blant pasienter med samme diagnose kan være svært forskjellig. Som et resultat er det viktig å behandle hver person med en kreftdiagnose som individ uavhengig av krefttype.
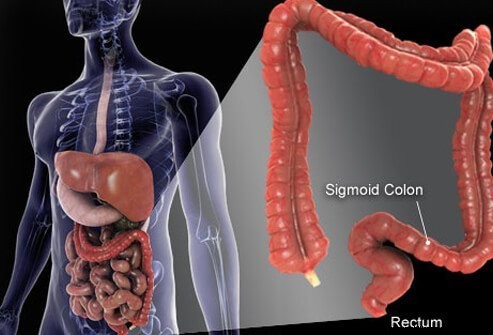
 Bilde av tykktarmskreft (kolorektal).
Bilde av tykktarmskreft (kolorektal).
Tyktarmen og endetarmen er de siste delene av røret som strekker seg fra munnen til anus. Mat kommer inn i munnen der den tygges og deretter svelges. Det går deretter gjennom spiserøret og inn i magen. I magen males maten til mindre partikler og kommer deretter inn i tynntarmen på en nøye kontrollert måte. I tynntarmen skjer endelig fordøyelse av mat og absorpsjon av næringsstoffene som finnes i maten. Maten som ikke blir fordøyd og absorbert kommer inn i tykktarmen (tykktarmen) og til slutt endetarmen. Tykktarmen fungerer først og fremst som et lagringsanlegg for avfall; Imidlertid fjernes ytterligere vann, salter og noen vitaminer ytterligere. I tillegg fordøyes noe av den ufordøyde maten, for eksempel fiber, av tykktarmsbakterier og noen av produktene fra fordøyelsen absorberes fra tykktarmen og inn i kroppen. (Det anslås at 10 % av energien som kommer fra mat kommer fra disse produktene fra bakteriell fordøyelse i tykktarmen.) Den gjenværende ufordøydte maten, døende celler fra tarmens slimhinne og et stort antall bakterier lagres i tykktarmen og gikk deretter med jevne mellomrom inn i endetarmen. Deres ankomst inn i endetarmen setter i gang en avføring som tømmer tykktarmsinnholdet fra kroppen som avføring.
Selv om tykktarmen er et rør, er det strukturelt et komplisert rør, mer som et radialdekk med stålbelte enn en hageslange. Røret består av fire lag. Det første er et indre lag av celler som langs hulrommet som den ufordøyde og fordøyende maten beveger seg gjennom, kalt slimhinnen. Slimhinnen er festet til et tynt andre lag, submucosa, som er festet til et muskellag, muscularis. Hele røret er omgitt av fibrøst (arrlignende) vev kalt serosa. De vanligste kreftene i tykktarmen (den typen som kalles adenokarsinom) oppstår fra slimhinnen, det indre laget av celler. Disse cellene utsettes for giftstoffer fra mat og bakterier samt mekanisk slitasje, og de snur seg relativt raskt (dør av og blir erstattet). Feil (vanligvis en serie feil som involverer gener i erstatningscellene) fører til unormale celler og ukontrollert spredning av de unormale cellene som gir opphav til kreft. Den raske omsetningen gjør at flere feil kan skje sammenlignet med vev som ikke snur seg så raskt (for eksempel levervev).
Det meste av tykktarmen hviler inne i et hulrom i magen som kalles bukhulen. Deler av tykktarmen er i stand til å bevege seg ganske fritt i bukhulen når den ufordøyde maten passerer gjennom den. Når tykktarmen går mot endetarmen, festes den til vevet bak bukhulen, et område som kalles retroperitoneum. Endedelen av tykktarmen, den delen som ligger i retroperitoneum, er endetarmen. I motsetning til mye av resten av tykktarmen, er endetarmen festet på plass av vevene som omgir den. På grunn av sin beliggenhet er behandling for endetarmskreft ofte annerledes enn behandling for kreft i resten av tykktarmen.
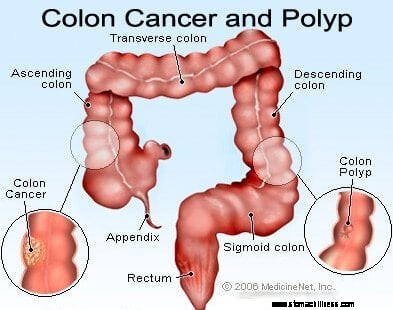
 Bilde av kolontverrsnitt.
Bilde av kolontverrsnitt. 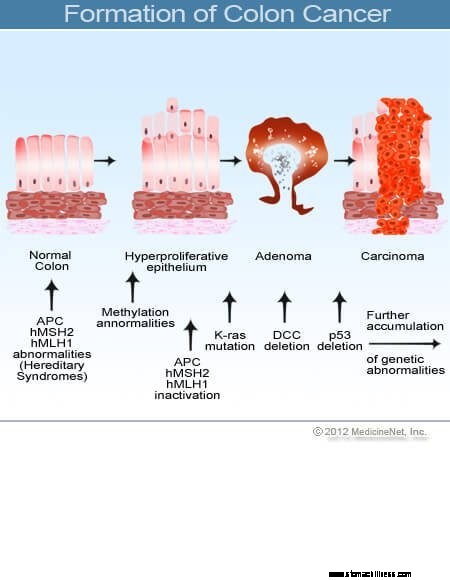 Bilde av tykktarmskreftdannelse.
Bilde av tykktarmskreftdannelse.
Den menneskelige tykktarmen (tykktarmen) er omtrent 6 fot lang.
Kreft i tykktarm og endetarm (kolorektal kreft) starter når prosessen med normal utskifting av tykktarmsceller går galt. Feil i celledeling forekommer ofte. Av grunner som er dårlig forstått, oppstår det noen ganger feil som slipper unna redigeringssystemene våre. Når dette skjer, begynner disse cellene å dele seg uavhengig av de normale kontrollene og balansene som kontrollerer veksten. Når disse unormale cellene vokser og deler seg, kan de føre til vekster i tykktarmen kalt polypper. Polypper varierer i type, men mange er precancerøse svulster som vokser sakte i løpet av årene og ikke sprer seg. Når polypper vokser, destabiliserer ytterligere genetiske mutasjoner cellene ytterligere. Når disse precancerøse svulstene endrer retning (vokser inn i veggen av røret i stedet for inn i rommet i midten av det) og invaderer andre lag av tykktarmen (som submucosa eller muskellaget), har den precancerøse polyppen blitt kreft. I de fleste tilfeller er denne prosessen sakte, og det tar minst åtte til ti år å utvikle seg fra de tidlige avvikende cellene til en ærlig kreft. Kolorektal kreft er vanligvis et adenokarsinom, et begrep som refererer til en kreft som har dannet seg i visse typer slimhinnevev i kroppen.
Når en tykktarmskreft først dannes, begynner den å vokse på to måter. For det første kan kreften vokse lokalt og strekke seg gjennom tarmveggen og invadere tilstøtende strukturer, noe som gjør massen (kalt primærsvulsten) mer problematisk og vanskeligere å fjerne. Lokal ekstensjon kan forårsake ytterligere symptomer som smerte eller fylde, perforering av tykktarmen eller blokkeringer av tykktarmen eller nærliggende strukturer. For det andre, etter hvert som kreften vokser, begynner den prosessen med metastase, og kaster tusenvis av celler om dagen inn i blodet og lymfesystemet som kan forårsake kreftform på fjerne steder. Kolorektale kreftformer sprer seg oftest først til lokale lymfeknuter før de reiser til fjerne organer. Når lokale lymfeknuter er involvert, er spredning til leveren, bukhulen og lungen de nest vanligste destinasjonene for metastatisk spredning.
Kolorektal kreft er den tredje vanligste årsaken til kreft i USA hos både menn og kvinner. Det påvirker over 135 000 mennesker årlig, som representerer 8 % av alle krefttilfeller. Omtrent 4,3 % av mennesker vil bli diagnostisert med tykktarms- eller endetarmskreft på et tidspunkt i livet.
Ved å klikke på «Send» godtar jeg MedicineNets vilkår og betingelser og personvernregler. Jeg godtar også å motta e-poster fra MedicineNet, og jeg forstår at jeg kan velge bort MedicineNet-abonnementer når som helst.
Helsepersonell er sikre på at tykktarmskreft ikke er smittsom (en person kan ikke få sykdommen fra en kreftpasient). Noen mennesker er mer sannsynlig å utvikle tykktarmskreft enn andre. Faktorer som øker en persons risiko for tykktarmskreft inkluderer økende alder, afroamerikansk rase, høyt fettinntak, en familiehistorie med tykktarmskreft og polypper, tilstedeværelsen av polypper i tykktarmen og inflammatoriske tarmsykdommer, først og fremst kronisk ulcerøs kolitt.
Økende alder er den viktigste risikofaktoren for tykktarmskreft. Rundt 90 % av kolorektal kreft blir diagnostisert etter fylte 50 år.
Afroamerikanere har en høyere forekomst av tykktarmskreft enn folk av andre raser.
Dietter med høyt fettinnhold har vist seg i en rekke forskningsstudier å disponere mennesker for tykktarmskreft. I land med høy forekomst av tykktarmskreft er befolkningens fettinntak mye høyere enn i land med lav forekomst av kreft. Det antas at fordøyelsen av fett som skjer i tynntarmen og tykktarmen fører til dannelse av kreftfremkallende kjemikalier (kreftfremkallende stoffer). På samme måte viser forskningsstudier også at dietter med mye grønnsaker og fiberrike matvarer som grovt brød og frokostblandinger inneholder mindre fett som produserer disse kreftfremkallende stoffene og kan motvirke effekten av kreftfremkallende stoffer. Begge effektene vil bidra til å redusere risikoen for kreft.
Forskning har vist at de fleste kolorektale kreftformer utvikles i kolorektale polypper. Derfor kan fjerning av godartede (men precancerøse) kolorektale polypper forhindre kolorektal kreft. Precancerøse kolorektale polypper kalles oftest adenomatøse polypper. De utvikler seg når kromosomskader oppstår i celler i den indre slimhinnen i tykktarmen. Skaden produserer unormale celler, men cellene har ennå ikke utviklet evnen til å spre seg, kjennetegnet på kreft. I stedet forblir det voksende vevet lokalisert i polyppen. Når kromosomskader øker ytterligere inne i polyppen, blir celleveksten ukontrollert, og cellene begynner å spre seg, det vil si at de blir kreft. Dermed får tykktarmspolypper som i utgangspunktet er godartede ytterligere kromosomskader for å bli kreft.
Kronisk ulcerøs kolitt forårsaker betennelse i den indre slimhinnen i tykktarmen. Tarmkreft er en anerkjent komplikasjon av kronisk ulcerøs kolitt. Risikoen for kreft begynner å øke etter åtte til 10 år med kolitt. Risikoen for å utvikle tykktarmskreft hos en pasient med ulcerøs kolitt er også relatert til plasseringen og omfanget av hans eller hennes sykdom.
Pasienter med høyere risiko for kreft er de med en familiehistorie med tykktarmskreft, langvarig ulcerøs kolitt, omfattende tykktarmsinvolvering med ulcerøs kolitt, og de med ulcerøs kolitt-assosiert leversykdom, skleroserende kolangitt.
Siden kreftene assosiert med ulcerøs kolitt har et gunstigere utfall når de fanges på et tidligere stadium, anbefales det ofte årlige undersøkelser av tykktarmen etter åtte år med kjent omfattende sykdom. Under disse undersøkelsene blir det tatt prøver av vev (biopsier) for å lete etter precancerøse forandringer i cellene i tykktarmen. Når det oppdages forstadier til kreft, kan fjerning av hele tykktarmen være nødvendig for å forhindre tykktarmskreft.
En persons genetiske bakgrunn er en viktig faktor i risikoen for tykktarmskreft. Å ha en førstegradsslektning med tykktarmskreft, spesielt hvis kreften ble diagnostisert før fylte 55 år, dobler omtrent risikoen for å utvikle tilstanden.
Selv om en familiehistorie med tykktarmskreft er en viktig risikofaktor, forekommer et flertall (80 %) av tykktarmskreft sporadisk hos pasienter uten familiehistorie med tykktarmskreft. Omtrent 20 % av krefttilfellene er assosiert med en familiehistorie med tykktarmskreft.
Kromosomer inneholder genetisk informasjon, og kromosomskader forårsaker genetiske defekter som fører til dannelse av tykktarmspolypper og senere tykktarmskreft. Ved sporadiske polypper og kreftformer (polypper og kreftformer som utvikler seg i fravær av familiehistorie), erverves kromosomskadene (utvikler seg i en celle i voksenlivet). De skadede kromosomene kan bare finnes i polyppene og kreftene som utvikler seg fra den cellen. Men ved arvelige tykktarmskreftsyndromer er kromosomfeilene arvet ved fødselen og er tilstede i hver celle i kroppen. Pasienter som har arvet generne for arvelig tykktarmskreftsyndrom er i fare for å utvikle tykktarmspolypper, vanligvis i unge aldre, og har svært høy risiko for å utvikle tykktarmskreft tidlig i livet; de er også i fare for å utvikle kreft i andre organer.
Familiær adenomatøs polypose (FAP) er et arvelig tykktarmskreftsyndrom der de berørte familiemedlemmene vil utvikle utallige antall (hundrevis, noen ganger tusenvis) av tykktarmspolypper som starter i tenårene. Med mindre tilstanden oppdages og behandles tidlig (behandling innebærer fjerning av tykktarmen), er en person som er rammet av FAP nesten sikker på å utvikle tykktarmskreft fra disse polyppene. Kreft utvikler seg nesten helt når en person er i 40-årene. Disse pasientene er også i fare for å utvikle andre kreftformer som kreft i skjoldbruskkjertelen, magen og ampulla (en del av gallegangen der den renner inn i tynntarmen fra leveren) samt godartede svulster som kalles desmoid-svulster. FAP oppstår fra en mutasjon i et spesifikt gen kalt APC-genet. Den spesifikke mutasjonen kan identifiseres hos de fleste mennesker med passende testing, og slik testing anbefales for individer diagnostisert med FAP så vel som deres familiemedlemmer.
Attenuert familiær adenomatøs polypose (AFAP) er en mildere versjon av FAP. Berørte medlemmer utvikler færre enn 100 kolonpolypper. Likevel har de fortsatt svært høy risiko for å utvikle tykktarmskreft i ung alder. De er også i fare for å få magepolypper og duodenale polypper.
Arvelig ikke-polypose tykktarmskreft (også kjent som Lynch syndrom eller HNPCC) er et arvelig tykktarmskreftsyndrom der berørte familiemedlemmer kan utvikle tykktarmspolypper og kreft, vanligvis i høyre tykktarm, i 30-40-årene. Pasienter med HNPCC er også i fare for å utvikle livmorkreft, magekreft, eggstokkreft og kreft i urinlederne (rørene som forbinder nyrene til blæren) og gallegangene. Ironisk nok ser det ut til at mens tykktarmskreft forekommer hyppigere hos pasienter med HNPCC, kan disse kreftene lettere helbredes enn "sporadiske" tykktarmskreft. De spesifikke genetiske abnormitetene assosiert med HNPCC er identifisert, og pasienter og familiemedlemmer kan testes for å avgjøre om HNPCC er tilstede og om familiemedlemmer bærer på abnormiteten og sannsynligvis vil utvikle kreft.
MYH polyposesyndrom er et nylig oppdaget arvelig kolorektal kreftsyndrom. Berørte medlemmer utvikler vanligvis 10 til 100 polypper rundt 40 år og har høy risiko for å utvikle tykktarmskreft. Også her er den genetiske abnormiteten identifisert.
Det er viktig å huske at det overveldende flertallet av kolorektal kreft ikke har en eneste identifiserbar kromosomavvik som kan ses etter hos slektninger for å identifisere individer med risiko for tykktarmskreft.
Symptomer relatert til kolorektal kreft er mange og uspesifikke. De inkluderer tretthet, svakhet, kortpustethet, endringer i avføringsvaner, smal avføring, diaré eller forstoppelse, rødt eller mørkt blod i avføringen, vekttap, magesmerter, kramper eller oppblåsthet. Andre tilstander som irritabel tarmsyndrom (spastisk kolon), ulcerøs kolitt, Crohns sykdom, divertikulose og magesår kan ha symptomer som etterligner tarmkreft.
Kolorektal kreft kan være tilstede i flere år før symptomene utvikler seg. Symptomene varierer etter hvor i tykktarmen svulsten befinner seg. Høyre kolon er bredere og mer fleksibel. Det kan til og med kalles relativt romslig sammenlignet med resten av tykktarmen. Kreft i høyre kolon kan vokse til store størrelser før de forårsaker abdominale symptomer. Vanligvis forårsaker høyresidige kreftformer jernmangelanemi på grunn av sakte tap av blod over lang tid. Jernmangelanemi forårsaker tretthet, svakhet og kortpustethet. Venstre kolon er smalere enn høyre kolon. Derfor er det mer sannsynlig at kreft i venstre tykktarm forårsaker delvis eller fullstendig tarmobstruksjon. Kreft som forårsaker delvis tarmobstruksjon kan forårsake symptomer på forstoppelse, innsnevret avføring, diaré, magesmerter, kramper og oppblåsthet. Lyst rødt blod i avføringen kan også indikere en vekst nær slutten av venstre tykktarm eller endetarm.
Når det er mistanke om tykktarmskreft, utføres en koloskopi vanligvis for å bekrefte diagnosen og lokalisere svulsten.
Koloskopi er en prosedyre der en helsepersonell setter inn et langt, fleksibelt visningsrør inn i endetarmen for å inspisere innsiden av hele tykktarmen. Koloskopi anses generelt som mer nøyaktig enn røntgenbilder av bariumklyster, spesielt ved påvisning av små polypper. Hvis kolonpolypper blir funnet, fjernes de vanligvis gjennom koloskopet og sendes til patologen. Patologen undersøker polyppene under mikroskopet for å se etter kreft. Koloskopi er den beste prosedyren å bruke når det er mistanke om kreft i tykktarmen. Mens flertallet av polyppene som fjernes gjennom koloskoper er godartede, er mange precancerøse. Fjerning av precancerøse polypper forhindrer fremtidig utvikling av tykktarmskreft fra disse polyppene.
Sigmoidoskopi er en prosedyre som utføres ved å bruke et kortere fleksibelt omfang for å undersøke kun venstre tykktarm og endetarm. Det er lettere å forberede og utføre enn en fullstendig koloskopi, men har åpenbare begrensninger i forhold til å ikke være lang nok til å vurdere både høyre og tverrgående tykktarm. Fjerning av polypper og kreftbiopsi kan utføres gjennom sigmoidoskopet.
Hvis det oppdages kreftvekster under koloskopi, kan små vevsprøver (biopsier) tas og undersøkes under mikroskop for å avgjøre om polyppen er kreft. Hvis tykktarmskreft bekreftes ved en biopsi, utføres stadieundersøkelser for å avgjøre om kreften allerede har spredt seg til andre organer. Siden kolorektal kreft har en tendens til å spre seg til lungene og leveren, inkluderer iscenesettelsestester vanligvis CT-skanninger av lungene, leveren og magen. Positron-emisjonstomografi (PET), en nyere test som ser etter den økte metabolske aktiviteten som er vanlig i kreftvev, brukes også ofte for å se etter spredning av tykktarmskreft til lymfeknuter eller andre organer.
Noen ganger kan helsepersonell få en "tumormarkør"-blodprøve kalt et karsinoembryonalt antigen (CEA) hvis det er mistanke om kreft. CEA er et stoff som produseres av noen tykktarms- og endetarmskreftceller, så vel som av noen andre typer kreft. Det er noen ganger funnet i høye nivåer hos pasienter med tykktarmskreft, spesielt når sykdommen har spredt seg. Det kan tjene som en nyttig test å følge hvis det viser seg å være forhøyet før kreften fjernes. Imidlertid vil ikke alle pasienter med tykktarmskreft ha en forhøyet CEA selv om kreften deres har spredt seg. (Noen tykktarmskreft produserer det ikke.) I tillegg er noen pasienter uten kreft kan ha en forhøyet CEA-blodprøve. Omtrent 15 % av røykere vil for eksempel ha en forhøyet CEA uten tykktarmskreft. Så CEA brukes ikke til å diagnostisere tykktarmskreft, men snarere til å følge effekten av behandling av tykktarmskreft hos noen med en kjent sykdomshistorie fordi, igjen, hos noen pasienter korrelerer mengden kreftvev med nivået av CEA.
Når kolorektal kreft er diagnostisert, utføres ytterligere tester for å bestemme omfanget av sykdommen. Denne prosessen kalles iscenesettelse. Iscenesettelse avgjør hvor avansert kolorektal kreft har blitt. Stadiene for tykktarmskreft varierer fra stadium I, den minst avanserte kreften, til stadium IV, den mest avanserte kreften.
Med hvert påfølgende stadium av tykktarmskreft øker risikoen for tilbakevendende kreft og død på grunn av spredning av kreft (metastaser). Som nevnt har tidligere kreftformer lavere risiko for tilbakefall og død. Når et individ har stadium IV kolorektal kreft, er prognosen dårlig. Men selv i stadium IV kolorektal kreft (avhengig av hvor kreften har spredt seg) eksisterer muligheten for en kur.
Kirurgi er den vanligste første medisinske behandlingen for tykktarmskreft. Under operasjonen fjernes svulsten, en liten margin av den omkringliggende friske tarmen og tilstøtende lymfeknuter. Kirurgen kobler deretter sammen de friske delene av tarmen. Hos pasienter med endetarmskreft fjernes endetarmen noen ganger permanent hvis kreft oppstår for lavt i endetarmen. Kirurgen lager deretter en åpning (kolostomi) på bukveggen som fast avfall fra tykktarmen skilles ut gjennom. Spesialtrente sykepleiere (enterostomale terapeuter) kan hjelpe pasienter med å tilpasse seg kolostomier, og de fleste pasienter med kolostomi går tilbake til en normal livsstil.
For tidlig tarmkreft er den anbefalte behandlingen kirurgisk fjerning. For de fleste med tidlig stadium av tykktarmskreft (stadium I og de fleste stadium II), er kirurgi alene den eneste behandlingen som kreves. Kjemoterapi kan tilbys noen personer med stadium II kreft som har faktorer som tyder på at deres svulst kan ha høyere risiko for tilbakefall. Men når tykktarmskreft har spredt seg til lokale lymfeknuter (stadium III), er risikoen for at kreften vender tilbake fortsatt høy selv om alle synlige bevis på kreften er fjernet av kirurgen. Dette skyldes en økt sannsynlighet for at små kreftceller kan ha rømt før operasjonen og er for små til å oppdage på det tidspunktet ved blodprøver, skanninger eller til og med direkte undersøkelser. Deres tilstedeværelse er utledet fra en høyere risiko for tilbakefall av tykktarmskreften på et senere tidspunkt (tilbakefall). Medisinske kreftleger (medisinske onkologer) anbefaler ytterligere tykktarmskreftbehandlinger med kjemoterapi i denne innstillingen for å redusere risikoen for at kreften kommer tilbake. Legemidler som brukes til kjemoterapi kommer inn i blodet og angriper tykktarmskreftceller som ble kastet inn i blodet eller lymfesystemet før operasjonen, og forsøker å drepe dem før de etablerer butikk i andre organer. Denne strategien, kalt adjuvant kjemoterapi, har vist seg å redusere risikoen for tilbakefall av kreft og anbefales for alle pasienter med stadium III tykktarmskreft som er friske nok til å gjennomgå det, så vel som for noen høyere risiko stadium II pasienter hvis svulst kan ha vist seg å ha blokkert eller perforert tarmveggen før operasjonen.
Det finnes flere forskjellige alternativer for adjuvant kjemoterapi for behandling av tykktarmskreft. Behandlingene involverer en kombinasjon av kjemoterapimedisiner gitt oralt eller i venene. Behandlingene gis vanligvis i totalt seks måneder. Det er viktig å møte en onkolog som kan forklare alternativer for adjuvant kjemoterapi samt bivirkninger å se opp for, slik at det riktige valget kan tas for en pasient som individ.
Kjemoterapi gis vanligvis på en helsepersonells klinikk, på sykehuset som poliklinisk eller hjemme. Kjemoterapi gis vanligvis i behandlingssykluser etterfulgt av restitusjonsperioder uten behandling. Bivirkninger av kjemoterapi varierer fra person til person og avhenger også av midlene som gis. Moderne kjemoterapimidler tolereres vanligvis godt, og bivirkninger for de fleste er håndterbare. Generelt ødelegger kreftmedisiner celler som vokser og deler seg raskt. Derfor kan normale røde blodlegemer, blodplater og hvite blodceller som også vokser raskt bli påvirket av cellegift. Som et resultat inkluderer vanlige bivirkninger anemi, tap av energi og lav motstand mot infeksjoner. Celler i hårrøttene og tarmen deler seg også raskt. Derfor kan kjemoterapi forårsake hårtap, munnsår, kvalme, oppkast og diaré, men disse effektene er forbigående.
Når kolorektal kreft har spredt seg fjernt fra det primære tumorstedet, beskrives det som stadium IV sykdom. Disse fjerne svulstavleiringene, som er fjernet fra den primære svulsten, har reist gjennom blodet eller lymfesystemet og dannet nye svulster i andre organer. På det tidspunktet er kolorektal kreft ikke lenger et lokalt problem, men er i stedet et systemisk problem med kreftceller både synlige på skanning og uoppdagelige, men sannsynligvis tilstede andre steder i kroppen. Som et resultat, i de fleste tilfeller, er den beste behandlingen kjemoterapi, som er systemisk terapi. Kjemoterapi ved metastatisk kolorektal kreft har vist seg å forlenge livet og forbedre livskvaliteten. Hvis det håndteres godt, er bivirkningene av kjemoterapi vanligvis langt mindre enn bivirkningene av ukontrollert kreft. Kjemoterapi alene kan ikke kurere metastatisk tykktarmskreft, men den kan mer enn doble forventet levealder og gi god livskvalitet under behandlingstiden.
Kjemoterapialternativer for kolorektal kreftbehandling varierer avhengig av andre helseproblemer som en person står overfor. For sterkere individer anbefales vanligvis kombinasjoner av flere kjemoterapeutiske legemidler, mens for sykere mennesker kan enklere behandlinger være best. Ulike multimedikamentregimer kombinerer midler med påvist aktivitet i tykktarmskreft som 5-fluorouracil (5-FU), som ofte gis sammen med legemidlet leucovorin (også kalt folinsyre) eller et lignende legemiddel kalt levoleucovorin, som hjelper det å virke bedre.
Capecitabine (Xeloda), er et kjemoterapimedisin gitt i pilleform. En gang i kroppen endres den til 5-FU når den kommer til svulststedet. Andre kjemoterapimedisiner for tykktarmskreft er irinotekan (Camptosar), oxaliplatin (Eloxatin) og trifluridin og tipiracil (Lonsurf), et kombinasjonsmedisin i pilleform. Chemotherapy regimens often have acronyms to simplify their nomenclature (such as FOLFOX, FOLFIRI, and FLOX).
Targeted therapies are newer treatments that target specific aspects of the cancer cell, which may be more important to the tumor than the surrounding tissues, offering potentially effective treatments with fewer side effects than traditional chemotherapy. Bevacizumab (Avastin), cetuximab (Erbitux), panitumumab (Vectibix), ramucirumab (Cyramza), regorafenib (Stivarga), and ziv-aflibercept (Zaltrap) are targeted therapies that have been used in the management of advanced colorectal cancer. These newer chemotherapeutic agents most often are combined with standard chemotherapy to enhance their effectiveness.
If the first treatment is not effective, second- and third-line options are available that can confer a benefit to people living with colorectal cancer.
Radiation therapy is the primary treatment of colorectal cancer has been limited to treating cancer of the rectum. As noted earlier, whereas parts of the colon move freely within the abdominal cavity, the rectum is fixed in place within the pelvis. It is in an intimate relationship with many other structures and the pelvis is a more confined space. For these reasons, a tumor in the rectum often is harder to remove surgically because space is smaller and other structures can be involved with cancer. As a result, for all but the earliest rectal cancers, initial chemotherapy and radiation treatments (a local treatment to a defined area) are recommended to try and shrink cancer, allowing for easier removal and lowering the risk of cancer returning locally. Radiation therapy is typically given under the guidance of a radiation specialist called a radiation oncologist. Initially, individuals undergo a planning session, a complicated visit as the doctors and technicians determine exactly where to give the radiation and which structures to avoid. Chemotherapy usually is administered daily while the radiation is delivered. Side effects of radiation treatment include fatigue, temporary or permanent pelvic hair loss, and skin irritation in the treated areas.
Radiation therapy will occasionally be used as a palliative treatment to reduce pain from the recurrent or metastatic colon or rectal cancer.
Follow-up exams are important for people with colorectal cancer. The cancer can come back near the original site, although this is unusual. If the cancer returns, it typically does so in a distant location such as the lymph nodes, liver, or lungs. Individuals diagnosed with colorectal cancer remain at risk of their cancer returning for up to 10 years after their original diagnosis and treatment, although the risk of recurrence is much higher in the first few years. Medical providers in the United States follow patients with physical examinations and blood tests including the CEA (if it was elevated before surgery) tumor marker every three months for the first two years and then with decreasing frequency thereafter. Patients are also followed with colonoscopies (starting one year after their diagnosis) and with CT scans (typically performed at least once yearly for the first two to five years).
If a recurrence is noted either locally or with metastatic spread, individuals may still be treated with the intention of cure. For example, if a new tumor were to recur in the liver, individuals can be treated with a combination of chemotherapy and surgery (or sophisticated radiation techniques) in hopes of eradicating the cancer completely. Evaluation in hospitals of excellence that specialize in liver surgery can help guide these complicated treatment decisions and increase the chances of cure even in the setting of metastatic disease.
In addition to checking for cancer recurrence, patients who have had bowel cancer may have an increased risk of cancer of the prostate, breast, and ovary. Therefore, follow-up examinations in the clinic should include cancer screening for these diseases, as well.
Colorectal cancers are typically slow-growing cancers that take years to develop. Because they grow most often in a step-wise manner, screening can greatly reduce the likelihood of death associated with the disease. Whether with virtual colonoscopy or newer screening techniques, the future must focus first and foremost on better, more comprehensive screening programs that find polyps and early cancers before they become life-threatening. The public also must be educated on the value of screening programs.
For those living with cancer, intensive research is ongoing to better understand cancer biology and genetics so that specific approaches can be developed to attack specific types of cancers and, more importantly, specific individuals' cancers. Each person living with cancer has a disease with a unique biology and genetic code and the secret to better treatments involves unlocking that code. Cancer is very complex and scientists are just beginning to unravel its secrets. Progress is frustratingly slow for those battling the disease. With each passing year, however, our understanding increases and treatments become more refined. If you or your family member is living with colorectal cancer, speak with your doctor about ways you can participate in research through clinical trials to help increase our knowledge and improve our therapies for this difficult disease.
Survival rates for any cancer are often reported by stage, the extent of spread when the cancer is identified. For colon and rectum cancer, around 39% are diagnosed at the local stage, before the cancer has spread outside the local area. The five-year survival for these patients with localized colon and rectum cancer is around 90%.
When the cancer has spread to the regional lymph nodes near the site of origin, the five-year survival rate is about 71%. When the cancer has metastasized to distant sites in the body (stage IV cancer), the five-year survival rate lowers to about 14%.
The most effective prevention for colorectal cancer is early detection and removal of precancerous colorectal polyps before they turn cancerous. Even in cases where cancer has already developed, early detection still significantly improves the chances of a cure by surgically removing the cancer before the disease spreads to other organs.
Regular physical activity is associated with lower risk of colon cancer. Aspirin use also appears to lower the risk of bowel cancer. The use of combined estrogen and progestin in hormone replacement therapy lowers the risk of colon cancer in postmenopausal women. Hormone replacement therapy has risks which must be weighed against this effect, and should be discussed with a doctor.
Blood tests are now available to test for hereditary colon cancer syndromes. Families with multiple members having colon cancers, multiple colon polyps, cancers at young ages, and other cancers such as cancers of the ureters, uterus, duodenum, and more, may take advantage of resources such as genetic counseling, followed possibly by genetic testing. Genetic testing without prior counseling is discouraged because of the extensive family education that is involved and the complicated nature of interpreting the test results.
The advantages of genetic counseling followed by genetic testing include:(1) identifying family members at high risk of developing colon cancer to begin colonoscopies early; (2) identifying high-risk members so that screening may begin to prevent other cancers such as ultrasound tests for uterine cancer, urine examinations for ureter cancer, and upper endoscopies for stomach and duodenal cancers; and (3) alleviating concern for members who test negative for the hereditary genetic defects.
People can change their eating habits by reducing fat intake and increasing fiber (roughage) in their diet. Major sources of fat are meat, eggs, dairy products, salad dressings, and oils used in cooking. Fiber is the insoluble, nondigestible part of plant material present in fruits, vegetables, and whole-grain breads and cereals. It is postulated that high fiber in the diet leads to the creation of bulky stools which can rid the intestines of potential carcinogens. In addition, fiber leads to the more rapid transit of fecal material through the intestine, thus allowing less time for a potential carcinogen to react with the intestinal lining.
The term "screening" is properly applied only to the use of testing to look for evidence of cancer or pre-cancerous polyps in individuals who are asymptomatic and at only average risk for a type of cancer. Those patients who, for example, have a positive family history of colon cancer, or are symptomatic for a colon abnormality, undergo diagnostic testing rather than screening tests.
There are different types of screening tests for colorectal cancer:fecal (stool) occult blood testing, sigmoidoscopy, colonoscopy, digital colonoscopy, and DNA testing of the stool. The US Preventive Services Task Force (USPSTF) recommends strongly that screening begin at age 50 years for average-risk adults, but there is no specific recommendation for one screening test or strategy over another. The USPSTF advises that patients be offered a choice of screening options, using shared decision-making with the patient and physician to arrive at the best choice of screening programs for each individual.
Tumors of the colon and rectum tend to bleed slowly into the stool. The small amount of blood mixed into the stool usually is not visible to the naked eye. The commonly used stool occult blood tests rely on chemical color conversions to detect microscopic amounts of blood. These tests are both convenient and inexpensive. There are two kinds of fecal occult blood tests. The first is known as a guaiac FOBT. In this test, a small amount of stool is smeared on a special card for occult blood testing when a chemical is added to the card. Usually, three consecutive stool cards are collected. The other type of FOBT is an immunochemical test in which a special solution is added to the stool sample and analyzed in the laboratory using antibodies that can detect blood in a stool sample. The immunochemical test is a quantitative test that is more sensitive and specific for the diagnosis of polyps and cancer. It is preferred over the guaiac test.
A person who tests positive for stool occult blood has a 30%-45% chance of having a colon polyp and a 3%-5% chance of having a colon cancer. Colon cancers found under these circumstances tend to be small and not to have spread and have a better long-term prognosis.
It is important to remember that having stool tested positive for occult blood does not necessarily mean a person has colon cancer. Many other conditions can cause occult blood in the stool. However, patients with a positive stool occult blood test should undergo further evaluations to exclude colon cancer and to explain the source of the bleeding. It is also important to realize that stool that has tested negative for occult blood does not mean that colorectal cancer or polyps do not exist. Even under ideal testing conditions, a significant percentage of colon cancers can be missed by stool occult blood screening. Many patients with colon polyps do not have positive stool occult blood. In patients suspected of having colorectal polyps and in those at higher risk for developing colorectal polyps and cancer, screening flexible sigmoidoscopies or colonoscopies are performed even if the FOBT is negative.
Flexible sigmoidoscopy is an exam of the rectum and the lower colon (60 cm or about 2 feet in from the outside) using a viewing tube (a short version of colonoscopy). Research studies have shown that the use of screening flexible sigmoidoscopy can reduce mortality from colon cancer. This is a result of the detection of polyps or early cancers in people with no symptoms. If a polyp or cancer is found, a complete colonoscopy is recommended. The majority of colon polyps can be completely removed at the time of colonoscopy without surgery; however, polyps in the proximal colon that cannot be reached by the sigmoidoscope will be missed. Flexible sigmoidoscopy is often combined with fecal occult blood testing for colorectal cancer screening.
Colonoscopy uses a long (120 cm-150 cm) flexible tube, which can examine the entire length of the colon. Through this tube, the doctor (typically a gastroenterologist) can both view and take pictures of the entire colon and also can take biopsies of colon masses and remove polyps.
Patients with a high risk of developing colorectal cancer may undergo screening colonoscopies starting at earlier ages than 50. For example, patients with a family history of colon cancer are recommended to start screening colonoscopies at an age 10 years before the earliest colon cancer diagnosed in a first-degree relative or five years earlier than the earliest precancerous colon polyp discovered in a first-degree relative. Patients with hereditary colon cancer syndromes such as FAP, AFAP, HNPCC, and MYH are recommended to begin colonoscopies early. The recommendations differ depending on the genetic defect. For example, in people with FAP, colonoscopies may begin during teenage years to look for the development of colon polyps. Patients with a prior history of polyps or colon cancer may also undergo colonoscopies to exclude recurrence. Patients with a long history (greater than 10 years) of chronic ulcerative colitis have an increased risk of colon cancer and should have regular colonoscopies to look for precancerous changes in the colon lining.
Virtual colonoscopy (computerized tomographic or CT colonography) has been utilized in the clinic as a screening technique for colorectal cancer. Virtual colonoscopy employs a CT scan using low doses of radiation with special software to visualize the inside of the colon and look for polyps or masses. The procedure typically involves a bowel preparation with laxatives and/or enemas (although not always) followed by a CT scan after air is introduced into the colon. Because no sedation is necessary, individuals can return to work or other activities upon completion of the test. Virtual colonoscopies appear to be equally able to detect larger polyps (over 1 centimeter in size) as regular colonoscopies. The virtual colonoscopy cannot be used to biopsy or remove tissue from the colon. A follow-up sigmoidoscopy or colonoscopy must be done to accomplish that.
The Cologuard test is available in the U.S. for in-home sample collection for adults over 50 at average risk for colon cancer. The sample is sent to a laboratory for analysis of DNA changes in DNA from cells shed by the intestinal lining into the stool or hemoglobin in the sample. In a research study, the test was able to find 92% of colon cancers and 69% of precancers of the colon. False-negative and false-positive results are also possible.
 Histaminintoleranse:8 årsaker, symptomsjekkliste og få lindring i dag
Histaminintoleranse:8 årsaker, symptomsjekkliste og få lindring i dag
 Den ultimate feilsøkingsveiledningen for fordøyelsessystemet:Hva du skal gjøre når kostholdet ikke hjelper mageproblemene dine
Den ultimate feilsøkingsveiledningen for fordøyelsessystemet:Hva du skal gjøre når kostholdet ikke hjelper mageproblemene dine
 Blæreinfeksjon (cystitt)
Blæreinfeksjon (cystitt)
 Hva får en person til å ha en kolostomipose?
Hva får en person til å ha en kolostomipose?
 Hvorfor symptomer på IBS kan bli verre under menstruasjonen
Hvorfor symptomer på IBS kan bli verre under menstruasjonen
 Oppdaterte tykktarmskreftscreeninger
Oppdaterte tykktarmskreftscreeninger
 Anti-coronavirus-molekyler fra mikrober kan være nøkkelen til nye behandlinger
Mikrober i tarmen som produserer fordelaktige forbindelser, kan inneholde nøkkelen til behandling av symptomer på koronavirus. Tarmmikrobiom. Bildekreditt:Anatomy Image/Shutterstock.com
Anti-coronavirus-molekyler fra mikrober kan være nøkkelen til nye behandlinger
Mikrober i tarmen som produserer fordelaktige forbindelser, kan inneholde nøkkelen til behandling av symptomer på koronavirus. Tarmmikrobiom. Bildekreditt:Anatomy Image/Shutterstock.com
 Halsbrann:Mat å spise, mat å unngå
Vil det gi meg halsbrann å spise dette? For å svare på dette spørsmålet må vi først forstå hva halsbrann er. Det er et brennende ubehag vanligvis i midten av brystet som fortsetter opp til halsen ho
Halsbrann:Mat å spise, mat å unngå
Vil det gi meg halsbrann å spise dette? For å svare på dette spørsmålet må vi først forstå hva halsbrann er. Det er et brennende ubehag vanligvis i midten av brystet som fortsetter opp til halsen ho
 Allergivennlige Halloween-godbiter
Halloween er en av de morsomste og mest skumle tidene på året – men det burde ikke være godbitene som skremmer oss! For mange mennesker kan høytider som sentrerer rundt snacks og godteri indusere mye
Allergivennlige Halloween-godbiter
Halloween er en av de morsomste og mest skumle tidene på året – men det burde ikke være godbitene som skremmer oss! For mange mennesker kan høytider som sentrerer rundt snacks og godteri indusere mye