Abstrakt
MikroRNA'er (miRNA) virke som transkriptionelle regulatorer og spille afgørende roller i carcinogenese. Ifølge miRNA target databaser, kan man miRNA regulere mange gener som sine mål, mens et gen kan målrettes ved mange miRNA. Disse resultater viser, at forholdet mellem miRNA og deres mål ikke kan være én-til-én. Men mange rapporter kun beskrevet en en-til-en, en-til-multiplum eller multiple-til-en-forhold mellem miRNA og dens målgen i humane cancere. Det er således nødvendigt at afgøre, om en kombination af nogle miRNA vil regulere flere mål og være involveret i carcinogenese. For at finde nogle grupper af miRNA, der kan synergistisk regulerer deres mål i human gastrisk cancer (GC), vi re-analyseret vores tidligere miRNA udtryk array-data og fandt, at 50 miRNA var opreguleret på behandling med 5-aza-2'-deoxycytidin i en GC cellelinie. Den "Targetscan" miRNA måldatabase forudsagt, at nogle af disse miRNA har fælles målgener. Vi henviste også til GEO-databasen for ekspression af disse fælles mål gener i human GC'er, som kunne være relateret til gastrisk carcinogenese. I denne undersøgelse har vi analyseret to miRNA kombinationer MIR-224 og -452, og MIR-181c og -340. Over-ekspression af begge miRNA kombinationer dramatisk nedreguleret deres målgener, DPYSL2 Henvisning:. Hashimoto Y, Akiyama Y, Yuasa Y (2013) Multiple-til-flere relationer mellem MikroRNA'er og målgener i Gastric Cancer. PLoS ONE 8 (5): e62589. doi: 10,1371 /journal.pone.0062589 Redaktør: Hiromu Suzuki, Sapporo Medical University, Japan Modtaget: December 14, 2012; Accepteret: 24 marts 2013; Udgivet: 8. maj 2013 | Copyright: © 2013 Hashimoto et al. Dette er en åben adgang artiklen distribueres under betingelserne i Creative Commons Attribution License, som tillader ubegrænset brug, distribution og reproduktion i ethvert medie, forudsat den oprindelige forfatter og kilde krediteres Finansiering:. Dette arbejde blev delvist understøttet af tilskud fra A3 Foresight Program for Japan Society for fremme af Science (JSP'er) (YY), og forskningsstipendier i JSP'er for Unge Forskere (YH). De finansieringskilder havde ingen rolle i studie design, indsamling og analyse af data, beslutning om at offentliggøre, eller forberedelse af manuskriptet Konkurrerende interesser:.. Forfatterne har erklæret, at der ikke findes konkurrerende interesser Introduktion Salg MikroRNA'er (miRNA), en klasse af små ikke-protein-kodende RNA'er, er blevet identificeret som en ny type gen regulator, der binder til 3'-utranslaterede regioner (UTR'er) af mål-mRNA, hvilket resulterer i mRNA nedbrydning eller blokaden af mRNA translation [1]. Det er almindeligt kendt, at miRNA ændringer er forbundet med tumorigenese [1]. Ifølge miRNA target databaser, kan man miRNA regulere mange gener som sine mål, mens et gen kan målrettes ved mange miRNA. Men talrige undersøgelser afslørede en en-til-en-forhold mellem miRNA og dens målgen. Det er også blevet rapporteret, at flere eller en klynge af miRNA co-operativt regulere et gen, som er relateret til carcinogenese [2] - [4]. På den anden side, er multiple gener der målrettes mod en miRNA [3], [4]. Selv multiple-til-flere relationer mellem miRNA og mål er blevet rapporteret ved brug af beregningsmæssige analyser [5], [6]. Imidlertid har der kun været et par papirer eksperimentelt validering flere-til-flere relationer i kræftceller. mavekræft er den fjerde mest almindelige menneskelige malign sygdom og den næsthyppigste årsag til kræft dødsfald på verdensplan, med en anslået en million nye tilfælde om året [7]. Gastriske kræftformer er histologisk klassificeres i to hovedtyper, tarm og diffuse typer [8]. Diffus-typen GC er ofte umedgørlig og udviser en dårlig patient prognose. Vi har for nylig demonstreret, at tabet af CDH1 og Trp53 funktioner inducerer diffus typen GC under anvendelse musemodeller [9]. Selv om denne konklusion vil hjælpe os til at udvikle nye humane gastrisk kræftbehandlinger, yderligere undersøgelser på den molekylære mekanismer underliggende gastrisk carcinogenese er nødvendige for at udvikle andre metoder til målrettet terapi. Promotor CpG ø hypermethylering er en af de mest almindelige mekanismer hvorved tumorsuppressorgener inaktiveres i humane cancere [10]. For nylig er det blevet klart, at nogle miRNA er også mål for epigenetisk inaktivering i kræft [11]. Vores og andre grupper har tidligere vist, at farmakologisk eller genetisk forstyrrelse af DNA-methylering i cancercellelinier inducerer opregulering af et betydeligt antal miRNA [12] - [15]. Disse data førte til identifikation af kandidat tumor-undertrykkende miRNA hvis lyddæmpning er forbundet med CpG ø methylering. Hidtil methylering af MIR-124 familiemedlemmer er blevet identificeret i colorektal cancer og i tumorer i andre organer [11]. Derudover MIR-34b /c klynge har en typisk CpG øen, og nedreguleres ved hjælp af hyppig methylering i tyk- og gastriske cancere [12]. Ligeledes fandt vi, at miR-181c methylering er forbundet med gastrisk carcinogenese via regulering af onkogene gener KRAS I denne undersøgelse at validere flere-til-flere relationer mellem miRNA og mål i kræftceller, viste vi, at to par flere miRNA, miR-224 og -452, og miR-181c og -340, havde flere målgener og synergistisk nedsat celledeling gennem regulering af deres mål i humane GC celler. Resultater 50 miRNA blev opreguleret i et GC Cell line, KATO-III, efter 5-aza-2'-deoxycytidin Behandling For at identificere kandidat miRNA som synergistisk påvirke deres målgener, vi re-analyseret vores tidligere microarray data (GEO accession No. GSE16006) [13]. Vi fandt, at miRNA niveauer var opreguleret på 5-aza-2'-deoxycytidin (5-aza-CdR) behandling, når netto- intensiteter af særlige 3 steder var mere end 1,5 gange. Desuden er vi også udvalgte miRNA som gennemsnittene viste sig at være steget mere end tre gange på microarray analyse. Baseret på disse nye kriterier, fandt vi, at 50 miRNA blev opreguleret i en GC-cellelinie, KATO-III (tabel S1). Vi bekræftede opreguleringen af 5 af 6 repræsentative precursor miRNA, dvs. MIR-145, -148a, -152, -224 og -340, efter 5-aza-CdR behandling med RT-PCR (figur 1A). Targetscan Forventet Common målgener af kandidatlandenes miRNA for at afgøre, hvorvidt epigenetisk regulerede miRNA har fælles målgener, vi søgte Targetscan databasen (version 5.1) for deres fælles mål. Ifølge Targetscan, kunne 50 miRNA klassificeres i 46 grupper baseret på deres frø sekvenser. Targetscan viste også, at disse 46 grupper kan målrette 6.460 gener. Blandt disse målgener, valgte vi 13, hvoraf ekspression blev rapporteret at være øget hos GC i GEO database (GEO accession No. GSE2685) eller at være relateret til gastrisk carcinogenese (tabel S2). Her har vi fokus på fire miRNA, miR-152, -181c, -224 og -340, fordi vi har allerede rapporteret, at miR-181c er epigenetisk nedreguleret i GC [13] og CpG øer er placeret i de opstrøms regioner tre andre miRNA (figur 2A og C, og fig S1). Figur 2a afslører også, at MIR-452 er grupperet med MIR-224. Targetscan forudsagde, at de fem miRNA kan regulere fælles mål. For eksempel, DPYSL2 Angivelse af miR-224, -452, -152 og -340 Nedsat på DNA Hypermethylering i GC cellelinjer Vi undersøgte inddragelse af epigenetiske ændringer i nedregulering af miRNA. Ekspressionen af MIR-224, -340 og -152 blev forøget med 5-aza-CdR behandling på flere GC cellelinjer (figur 1b). Vi analyseret kvantitativt modent MIR-224-ekspression i 9 GC cellelinjer og en kolorektal cancer (CRC) cellelinie. Ingen udtryk for miR-224 blev påvist i 7 af 10 cancer cellelinier (figur 1C). Vi analyserede også ekspressionen ændring af MIR-224 /-452 klynge i KATO-III-celler behandlet med en lav dosis af 5-aza-CdR (0,2 pmol /l), en histondeacetylaseinhibitor, Trichostatin A (TSA, 0,3 pmol /l), eller en kombination af disse to lægemidler. KATO-III celler med lav dosis 5-aza-CdR behandling udstillet opregulering af miR-224 /-452 klynge, mens TSA alene ikke forårsagede opregulering. MIR-224 /-452 klynge blev synergistisk opreguleret i KATO-III celler med kombineret 5-aza-CdR og TSA behandling (Figur 1D). Disse resultater indikerer, at MIR-224 og MIR-452 kan nedreguleres via DNA-methylering i GC-cellelinier som den samme transkriptionsenhed. Det er blevet rapporteret, at intron miRNA reguleres gennem promotor methylering af deres vært gener [14], [15]. Ifølge resultaterne af beregningsmæssige analyse, er det miR-224 /-452 klynge og miR-340 placeret i intron 6 i Gabre For at bestemme om epigenetisk reguleret miRNA er tumor-undertrykkende eller ej, vi evaluerede effekten af 5-aza-CdR i siDICER1-transficerede KATO-III og DICER1 KO HCT116 (D1KO) celler (figur 4A). De ubehandlede KATO-III og forældrenes HCT116 celler viste decelererede proliferation efter behandling med 5-aza-CdR. På den anden side, i siDICER1-transficerede KATO-III og D1KO celler, virkningen af 5-aza-CdR behandling på celleproliferation blev svag i begge tilfælde. Disse resultater antyder, at virkningen af 5-aza-CdR blev reduceret i lave eller nul DICER1 celler, og at epigenetisk regulerede miRNA spiller en vigtig rolle i GC og CRC-celler. For at analysere forholdet mellem disse miRNA og 13 målgener vist i tabel S2, transficerede vi KATO-III-celler med siDICER1 og /eller behandlet med 5-aza-CdR. Selv udtryk af 3 ( DPYSL2 Kombinatorisk transfektion af mIR-224 og -452 Fortrængning GC celleproliferation Vi transficerede GC-cellelinier med miR-224 og /eller -452 efterligner som en repræsentant for miRNA klynger, eller en negativ kontrol, og derefter udføres tetrazolium-8 (WST-8) analyser vand-løst. Tooghalvfjerds timer efter transfektion, observerede vi, at ektopisk ekspression af MIR-224 eller -452 undertrykkes væksten af to cellelinjer, KATO-III og AGS (figur 5A). Især multikombinerbare transfektion af miR-224 og -452 efterligner udførligt faldt væksten i de to GC cellelinjer (figur 5A). for at undersøge, om miR-224 /-452 klynge faktisk er relateret til reguleringen af DPYSL2 Vi undersøgte effekten af knockdown af DPYSL2 Kombinatorisk Transfektion af miR-340 og -181c Fortrængning GC Cell Proliferation, og induceret nedregulering af KRAS Som et andet eksempel på flere-til-flere relationer mellem microRNA og målgener, vi analyserede forholdet mellem miR-340 /-181c og KRAS /MeCP2 . Vi undersøgte status methylering af miR-224 og -340 i primære GC tilfælde. Methylerede mønstre af MIR-224 blev påvist i 15 af 26 (57,7%) primære GC væv (figur 7A og tabel 1). Parret ikke-kræft gastrisk slimhinde næppe udviste en methylering mønster af MIR-224. Dernæst vi kvantitativt undersøgte miR-224 niveauer i primære GC væv og tilsvarende ikke-kræft slimhinder ved TaqMan RT-PCR. En væsentlig reduktion af miR-224-ekspression i GC væv blev observeret i methylering-positive kræfttilfælde i forhold til i methylering-negative dem og ikke-kræft gastrisk slimhinder (Figur 7C). Vi analyserede yderligere DPYSL2 MIR-340 methylering frekvens var relativt lav i de testede primære GC væv (4 af 26, 15,4%) (figur 7B og tabel 1), mens ingen af 26 parrede ikke-kræft gastrisk slimhinder udstillet tilsyneladende methylering mønstre af miR-340. Som for MIR-152 methyleringsanalyse, forsøgte vi tre primersæt designet i regionen opstrøms for MIR-152 indeholdende CpG øer (fig S1), men ingen af dem helt matchede MIR-152-ekspression på MFP-analyser (data ikke vist). diskussion Selv om det er blevet rapporteret, at ekspressionen af visse miRNA er nedsat hos flere kræftformer gennem DNA-methylering, de fleste rapporter beskrevet, at forholdet mellem afvigende ekspression af miRNA og dets målgener var en-til-en, en-til-multiplum eller multiple-til-én. For at undersøge muligheden for flere-til-flere relationer mellem miRNA og mål i kræftceller, vi fokuserede på to kombinationer af miRNA i GC celler, den miR-224 /-452 klynge, og miR-181c og -340, i denne undersøgelse . Vi fandt, at de to sæt miRNA, miR-224 og -452, og miR-181c og -340, havde flere målgener, DPYSL2 MIR-224- og /eller -340-udtryk-negative GC cellelinjer udstillede hypermethyleringsassocierede signaler på MSP analyse og ekspression af miR-224 og -340 restaureret på demethyleringsmiddel behandling. Desuden hypermethylering af miR-224 og -340 blev observeret hyppigere i primære GCS end tilsvarende noncancerous slimhinder. I MIR-224 methylering-positive tilfælde, ekspression af MIR-224 var signifikant lavere end i methylering negative. Disse data indikerer stærkt, at afvigende DNA methylering er en af de vigtigste mekanismer bag nedregulering af miR-224 og -340 i GC celler. Vi viste, at hæmning af miRNA behandling af siDICER1 transfektion eller ved hjælp DICER1 knockout celler faldt virkningen af 5-aza-CdR, dvs. nedsat celleproliferation og nedregulering af målgener, i GC og CRC-celler. Det er blevet rapporteret, at den høje DICER1, det enzym, der katalyserer det sidste trin af miRNA modning, er direkte forbundet med tumorudvikling [17]. Disse resultater antyder, aberrerende regulering af miRNA modning bidrager til GC og CRC-dannelse. Vi fandt, at MIR-224 /-452 klynge blev aberrerende nedreguleret i GC'er gennem hypermethylering. Afvigende ekspression af MIR-224 er også blevet rapporteret i andre tumorer. Ekspression af miR-224, lad-7f og miR-516a er faldet i æggestokkræft, og de synergistisk regulerer ekspressionen af kallikrein-relaterede peptidase 10 (KLK10) [18]. MIR-224 er nedreguleret i methotrexat-resistente CRC cellelinier sammenlignet med i følsomme celler [19]. Her er vi viste også, at status methylering af miR-224 blev korreleret med DPYSL2 Vi undersøgte de fælles mål for epigenetisk nedreguleret miRNA. DPYSL2 Sammenfattende vores resultater viser, at multiple-til-flere relationer mellem miRNA og målgener virkelig eksisterer i GC. Det er sandsynligt, at afvigende methylering nedsætter ekspressionen af multiple tumor-undertrykkende miRNA, såsom MIR-224, -452, -340 og -181c, som derefter inducere overekspression af flere onkogene gener, såsom KRAS Materialer og metoder etik Statement skriftligt informeret samtykke blev opnået fra alle fag, og den etiske komité i Tokyo Medicinsk og Dental University School of Medicin godkendt denne forskning. cellelinier og vævsprøver Vi studerede 9 GC cellelinjer (KATO-III, MKN45, AGS, MKN74, TGBC11TKB, HSC59, HSC43, HSC58 og GCIY), 2 CRC cellelinjer (HCT116 og DICER1 Vi henvist til GEO database for miRNA og genekspressionsprofiler (tiltrædelse GEO No. GSE16006 og GSE2685). Vi brugte også miRNA måldatabase "Targetscan". For demethylering studier blev celler dagligt behandlet med 5 pmol /l 5-aza-CdR (Sigma- Aldrich, St. Louis, MO) i 72 timer. Vi har også behandlede celler med 0,3 pmol /l TSA alene og med en kombination af 0,2 pmol /l 5-aza-CdR og TSA. Totalt RNA blev isoleret ved anvendelse af Trizol-reagens (Invitrogen, Carlsbad, CA) eller en miRNeasy mini kit (Qiagen, Hilden, Tyskland). blev udført ved anvendelse af et StepOne real-time PCR System (Applied Biosystems, Foster City, CA) real-time revers transkription-polymerasekædereaktion (RT-PCR) analyser, EagleTaq Master Mix med ROX (Roche, Mannheim, Tyskland), en TaqMan Reverse Transcription kit (Applied Biosystems), og TaqMan miRNA assays (Applied Biosystems) ifølge producentens anvisninger. Ekspressionsniveauerne af miRNA blev beregnet på grundlag af mængden af mål miRNA forhold til den for RNU6B som en kontrol til at normalisere den oprindelige indgang af totalt RNA. bisulfitbehandling af DNA var udført med Methylamp (Epigentek, Brooklyn, NY). Methyleringsspecifik polymerasekædereaktion (MSP) analyser blev udført som tidligere [26] beskrevne. Primersekvenserne og PCR-produktet størrelser er vist i tabel S3. KATO-III og AGS-celler blev transficeret med et forstadiemolekyle efterligne MIR-224, -452, -340 eller -181c, eller krypteret sekvens miRNA (Sigma) til opnåelse af en slutkoncentration på 25-50 nmol /l ved anvendelse af en elektroporator, Neon (Invitrogen) ifølge producentens instruktioner. Ved 24-72 timer efter transfektion blev cellerne høstet til RT-PCR eller Western blot-analyse. MIR-mimic-transficerede KATO-III og AGS-celler blev udpladet ved 1 × 10 3 eller 1 × 10 4 celler per brønd på 96-brønds plader. Celleproliferation blev vurderet på dag 1-4 efter transfektion ved bestemmelse af antallet af celler med celleproliferation reagens WST-8 (Dojindo Molecular Technologies, Inc., Mashikimachi, Japan), ifølge producentens instruktioner. De forudsagte mål for miRNA og deres målsteder blev analyseret ved hjælp Targetscan. MRNA ekspressionsniveauer af de forudsagte mål i transient transficerede celler blev analyseret 24 timer efter transfektion ved RT-PCR. Western blot analyser blev udført som tidligere [26] beskrevne. Det primære antistof blev anvendt, var kanin-anti-DPYSL2 (1:500;Ϋ3, Cell Signaling Technology, Danvers, MA). Vi brugte muse-anti-α-tubulin (1:1000; sc-8085, Santa Cruz Biotechnology) som en intern kontrol for Western blotting. De sekundære antistoffer blev anvendt, var alkalisk phosphatase-konjugeret anti-kanin-IgG og anti-mus IgG (1:2000; Bio-Rad Laboratories, Hercules, CA). Blots blev udviklet med ImmunoStar AP Substrat (Bio-Rad Laboratories). Tak Vi vil gerne takke Dr. Bert Vogelstein for at give DICER1 knock-out HCT116 cellelinie.
og KRAS
, og KRAS
MeCP2
hhv. Disse miRNA kombinationer synergistisk nedsat celleproliferation ved transfektion. Desuden afslørede vi, at disse miRNA blev nedreguleret gennem promotor hypermethylering i GC celler. Det er således sandsynligt, at forholdet mellem miRNA og deres mål er ikke én-til-en, men flere til-multiplum i GC'er, og at disse komplekse relationer kan være relateret til gastrisk carcinogenese
NOTCH4
[13]. Nedregulering af mange miRNA gennem methylering samtidig forekommer i kræftceller, og kan øge flere-til-flere relationer mellem miRNA og mål.
(dihydropyrimidinase-lignende 2, også kendt som kollapse svar mediator protein 2, CRMP2
) er målrettet efter miR-224, -452, og -181c, KRAS
af mIR-224, -452, -181c, -340 og -152, og MeCP2
(methyl CpG bindende protein 2) ved mIR-181c og -340, henholdsvis (figur 3).
og intron 2 i RNF130
henholdsvis som begge indeholde tætte CpG-øer kun i promotorregionerne værtsstaternes gener (figur 2A og C). Vi undersøgte forholdet mellem ekspressionsniveauerne af disse miRNA og status for methylering af deres værtsgener i GC-cellelinier ved MSP-analyse. GC cellelinjer uden MIR-224 ekspression sås der kun methylering signaler, hvorimod udtrykket-positive cellelinjer udviste stærke unmethylation mønstre (figur 2B). Et lignende forhold blev påvist for MIR-340 i GC-cellelinier (figur 2D). Disse data indikerer, at ekspression af disse miRNA i GC cellelinjer kan slukkes ved promotor methylering af deres vært gener.
epigenetisk regulerede miRNA kan være relateret til GC Cell Proliferation
, KRAS
MeCP2
) af de 13 gener blev nedsat efter 5-aza-CdR behandling, udtryk for disse gener gjorde ikke ændre på 5-aza-CdR behandling efterfulgt af transfektion af siDICER1 (figur 4B).
MIR-224 /-452 Cluster Co-operativt Nedsat Angivelse af DPYSL2
KRAS
og KRAS
analyserede vi ekspressionen af DPYSL2
efter transfektion af KATO-III og AGS celler med mIR-224 /-452 klynge alene eller sammen. Vi udførte RT-PCR og Western blot-analyser. DPYSL2
KRAS
mRNA niveauer blev nedsat efter transfektion med miR-224 eller miR-452 efterligner (figur 5B). Interessant nok i tilfælde af multikombinerbare transfektion med MIR-224 og -452, ekspression af disse målgener blev yderligere nedreguleret (figur 5B). Nedreguleringen af DPYSL2 blev også observeret på proteinniveauet i de to cellelinier (figur 5C). Vi undersøgte også ekspressionsniveauerne af fem andre gener, MeCP2, MYC, JunB, MUC1
SETDB1
, som ikke blev vist som mål for miR-224 eller -452 af Targetscan. Som forventet blev der ikke fundet udtryksmæssige ændringer i disse fem gener i KATO-III celler efter transfektion med miR-224 eller -452 (Figur S2). Disse data tyder på, at miR-224 og -452 specifikt nedreguleret DPYSL2
KRAS
.
DPYSL2
blev associeret med GC Cell Proliferation
, som viste sig at være et mål af miR-224 /-452 klynge, på celleproliferation. Den transfektion af DPYSL2
siRNA klart faldt niveauerne af DPYSL2
udskrifter (figur 5D), og hæmmede væksten af AGS og KATO-III celler 72 timer efter knockdown af DPYSL2
(figur 5E), hvilket indikerer, at DPYSL2 har en onkogen aktivitet.
og MeCP2
Expression
Når miR-340 og miR-181c blev transficeret ind KATO-III celler, spredning var synergistisk nedreguleret af to miRNA (figur 6A). For at afgøre, hvorvidt epigenetisk reguleret miR-340 og miR-181c co-operativt påvirke deres mål, vi analyserede mRNA niveauerne af KRAS
MeCP2.
On RT-PCR-analyse, KRAS
MeCP2
viste sig at være nedreguleret af miR-340 og miR-181c alene eller kombinatoriske transfektion i KATO-III-celler (figur 6B). Med hensyn til de fire gener, MYC, JunB, MUC1
SETDB1
, som ikke udviser forudsagte steder for disse to miRNA efter Targetscan, ekspressionsniveauerne blev ikke ændret i denne undersøgelse. Repræsentative data er vist i figur 6B. Således kan effekten af miR-340 og -181c være specifikke for deres fælles målgener samt miR-224 og -452.
Expression og Methylering Status for miR-224 og -340 i Primary GC Cases
mRNA-niveauer i sammenligning med status methylering af miR-224 i GC væv: GCS med miR-224 methylering (Ca miR-224 Mt), GCS med miR-224 unmethylation (Ca miR-224 Un), og ikke -cancerous væv med unmethylation (N miR-224 Un). DPYSL2
mRNA niveau i "Ca miR-224 Mt" gruppe var signifikant højere end i "N miR-224 Un" og "Ca miR-224 Un" grupper, p = 0,049 og p = 0,035, henholdsvis (figur 7D). Der er således en sammenhæng mellem status methylering af miR-224 og DPYSL2
udtryk i GC væv.
og KRAS
, og KRAS
MeCP2
henholdsvis og synergistisk nedsat celledeling i humane GC cellelinjer. Det er bemærkelsesværdigt, at et onkogen, KRAS
[16], viste sig at være målrettet med fire miRNA, selvom kandidat bindingssteder af de fire miRNA er forskellige i 3'-UTR af KRAS
(Targetscan). Vi har tidligere rapporteret, at miR-181c nedreguleret NOTCH4
også [13]. Således multiple-til-flere relationer mellem miRNA og mål blev indikeret ikke kun af database analyser, men også af transfektionsforsøg involverer humane celler.
niveau i human GC'er. Tilsammen MIR-224 spiller en vigtig rolle som et tumor-undertrykkende miRNA i GC samt i flere andre kræftformer. I modsætning hertil er miR-224 opreguleret i hepatocellulære karcinomer [20] og medulloblastomer [21] sammenlignet med de normale væv. Således er yderligere undersøgelser for at klarlægge rolle miR-224 i carcinogenese.
viste sig at blive nedreguleret af miR-224 og -452. DPYSL2 spiller en vigtig rolle i etableringen af neuronal polaritet [22]. DPYSL2 er også involveret i veje, der regulerer proliferation af ikke-neuronale celler gennem dets phosphorylering af regulatoriske proteiner. DPYSL2 undergår dynamiske phosphorylerings- ændringer som reaktion på kontaktinhibering-induceret ubevægelighed og hyperphosphorylering af DPYSL2 forekommer i en tumor [22]. Selv er ikke klart rolle DPYSL2 i GC'ers, vores siRNA-baserede knockdown af DPYSL2 udtryk inducerede en reduktion af spredning i de to GC cellelinjer, hvilket tyder onkogen aktivitet DPYSL2.
, DPYSL2
, og MeCP2
. Disse unormale flere-til-flere relationer mellem miRNA og mål ville være en af de vigtige mekanismer underliggende gastrisk carcinogenese. Det er derfor meget muligt, at epigenetiske lægemidler kan normalisere ekspressionen af ikke kun tumor-undertrykkende gener, men også flere tumor-undertrykkende miRNA, hvilket resulterer i fald i de abnorme multiple-to-multiple relationer mellem miRNA og mål, og dermed kan blive fremragende terapeutiske lægemidler mod kræft.
knock out HCT116 [23]), og 26 primære GC sager. MKN45, MKN74, TGBC11TKB og GCIY blev indkøbt fra Riken cellebank, og KATO-III og AGS var fra ATCC (American Type Cell Collection). HSC59, HSC43 og HSC58 blev opnået fra Dr. Kazuyoshi Yanagihara [24], [25]. KATO-III, MKN45, MKN74, HSC59, HSC43 og HSC58 blev dyrket i RPMI 1640, og AGS, TGBC11TKB, GCIY og de to CRC cellelinier i Dulbeccos modificerede Eagles medium, minimalt essentielt medium eller McCoys 5A suppleret med 10% føtalt bovint serum. Kirurgisk resektion prøver fra 26 primære GC patienter blev tilfældigt opnået fra Tilknyttede Hospital i School of Medicine, Tokyo Medical og Dental University.
I silico Analyse
Drug Treatment Celler og RNA Extraction
kvantitativ real-time Reverse Transcription-polymerase Chain Reaction
methyleringsanalyse
Synthetic miRNA Transfektion
celleproliferationsassay
miRNA Target Forudsigelse og vestlige Blotting
Støtte oplysninger
figur S1.
Skematisk repræsentation af COPZ2
region, der indeholder miR-152. Fyldte kasser repræsenterer exoner af COPZ2
A og en tom kasse betegner den uoversatte region COPZ2
. En bøjet pil angiver transkriptionsstartstedet af COPZ2
. En lodret pil angiver placeringen af miR-152. Lodrette linje viser CpG sites. Pilespidser angiver de undersøgte for MSP regioner
doi:. 10,1371 /journal.pone.0062589.s001
(TIFF)
Figur S2. Salg Virkninger af transfektion af MIR-224 og -452 i KATO-III-celler. RT-PCR-analyser efter transfektion med MIR-224 og /eller -452. Ekspressionen af målgener blev analyseret 48h senere ved RT-PCR. miR-224 og -452 specifikt nedreguleret DPYSL2
KRAS
, men ikke andre fem gener, undersøgt, som er i overensstemmelse med resultaterne af database analyse (figur 3).
doi: 10,1371 /journal.pone.0062589.s002
(TIFF)
tabel S1.
Expression profilering af menneskelige miRNA i KATO-III celler efter 5-aza-CdR behandling
doi:. 10,1371 /journal.pone.0062589.s003
(XLSX)
tabel S2.
Liste over målgener af hvilken ekspression vi undersøgt ved RT-PCR efter behandling med eller uden 5-aza-CdR og transfektion med 20 nmol /l af siDICER1 eller krypteret siRNA
doi:. 10,1371 /journal.pone .0062589.s004
(XLSX)
tabel S3. Salg Sekvenser af primere, der anvendes i denne undersøgelse
doi:. 10,1371 /journal.pone.0062589.s005
(XLSX)
 Beskæftiger sig med irritabel tarmsyndrom
Beskæftiger sig med irritabel tarmsyndrom
 Husholdningsdesinfektionsmidler kan bidrage til fedmerisiko hos børn
Husholdningsdesinfektionsmidler kan bidrage til fedmerisiko hos børn
 Parkinsons sygdom kan forebygges af tarmmikrober
Parkinsons sygdom kan forebygges af tarmmikrober
 Migration påvirker tarmmikrobiota, hvilket igen påvirker sundhedsfundforskere
Migration påvirker tarmmikrobiota, hvilket igen påvirker sundhedsfundforskere
 Plast findes nu almindeligt i afføring hos mennesker
Plast findes nu almindeligt i afføring hos mennesker
 Gedemælkbaseret formel god til spædbørns tarmsundhed
Gedemælkbaseret formel god til spædbørns tarmsundhed
 Fortsæt,
Spis kameraet - kapselendoskopi Når en stor hvidhaj fanges, og han menes at have stået bag et angreb, skæres fiskens mave op. Alle slags ting kommer normalt ud af maven, herunder en flok hele små fis
Fortsæt,
Spis kameraet - kapselendoskopi Når en stor hvidhaj fanges, og han menes at have stået bag et angreb, skæres fiskens mave op. Alle slags ting kommer normalt ud af maven, herunder en flok hele små fis
 Husdyr, der sandsynligvis ikke overfører SARS-CoV-2,
siger forskere Forskere i Spanien og Tyskland har foretaget en undersøgelse, der viser, at hunde sandsynligvis ikke vil bidrage til overførsel og spredning af alvorligt akut respiratorisk syndrom coro
Husdyr, der sandsynligvis ikke overfører SARS-CoV-2,
siger forskere Forskere i Spanien og Tyskland har foretaget en undersøgelse, der viser, at hunde sandsynligvis ikke vil bidrage til overførsel og spredning af alvorligt akut respiratorisk syndrom coro
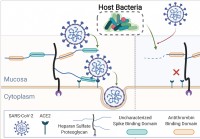 Humant mikrobiom beskærer slimhindeglykaner,
påvirker SARS-CoV-2 infektion Et internationalt forskerteam har gennemført en undersøgelse, der viser, at forskelle i det humane mikrobiom kan påvirke alvorligt akut respiratorisk syndrom coronavirus
Humant mikrobiom beskærer slimhindeglykaner,
påvirker SARS-CoV-2 infektion Et internationalt forskerteam har gennemført en undersøgelse, der viser, at forskelle i det humane mikrobiom kan påvirke alvorligt akut respiratorisk syndrom coronavirus